
第六节 总结与展望
一、2016年血源安全检测的整体发展状况
1.核酸检测市场状况
核酸检测(NAT)技术作为血液筛查的一种新检测方法,可明显缩短检测方法的“窗口期”,降低输血感染病毒带来的风险,因此,核酸检测技术成为欧美发达国家血源筛查的必要检测手段。根据我国现行法规要求,用于血源筛查的体外诊断技术按照药品管理。
国外使用核酸检测的发展历史。日本是世界上最早对血液筛检的国家,德国和荷兰从1997年开始使用NAT进行筛检的上市,英国和法国的部分血站也从2000年开始可NAT血液筛检,美国则从1993年3月开始在FDA新药审核程序下使用不同的试剂进行常规血液筛检。各国根据自身特点,采用不同的技术方式组合,目的是既能保证血液安全,又能确保血液及时供给。
2000年3月,我国卫生部在12个省市的15个血液中心进行核酸试点工作,试点后的血液安全性大大提高。2002年,我国血液制品管理部门先后对原料血浆进行核酸检测研究,并更具国家食品药品监管机构的要求拟定了相关的技术文件。2011年8月,在哈尔滨召开的全国血液安全工作会议上,要求有条件采用核酸检测技术的省份尽量采用核酸检测方法。卫计委印发《全面推进血站核酸检测工作实施方案(2013年~2015年)》指出,中国到2015年,血液筛查核酸检测基本覆盖全国。经中国国家药监局(SFDA)批准,可应用于血液病毒NAT检测的系统有美国诺华公司的Tigris检测系统,采用TMA化学发光技术;罗氏公司的s201检测系统采用荧光PCR扩增技术;上海科华、中山达安、上海浩源血源筛查系统,均采用荧光定量PCR法。欧美血液中心和血液制品厂家已经普遍采用核酸筛查献血员和原料血浆,WHO生物标准化委员会也有专门会议讨论并认定NAT可作为血液和血液制品病毒安全性检测的使用。
2. 整体免疫血液学市场分析
免疫血液学检测市场包含所有检测相关的仪器,试剂和服务。根据血液制品“血管到血管”的生命周期——献血、处理、运输、相容性检测、输血,可以将免疫血液学检测市场分为采供血市场和临床市场,其中临床市场占据了整个中国IH市场的60%~70%。近年来,中国IH市场依然保持着加速增长态势,据Boston Biomedical consultants市场报告显示,2013年及2014年度中国免疫血液学检测市场销售额均比上年增长12%;2015年度中国免疫血液学检测销售额更是达到了8.19亿人民币,比上年度增长了14%。由于采供血机构血液捐献量增长不显著,故对整体行业市场增长贡献有限,临床部分的增长决定了IH市场整体的表现。加速增长的驱动力主要来自于,输血安全推动的三级和二级医院检测量的持续扩增,以及更加安全和规范的检测技术及程序的广泛应用。本章节主要关注临床免疫血液学检测市场。
医院早期的免疫血液学检测以手工试管发为主,随着对血液质量和输血安全的更高要求,迫切需要灵敏度更高、更集约、更易标准化的检测方法。在这种迫切需求的推动下,众多IH检测方法应运而生(详见第二章)。1985年,法国科学家Yves Lapierre博士开发了柱凝集技术(Column Agglutination Technique,CAT)。这项技术以其灵敏度高、操作简便、容易判读等优点,使全世界免疫血液学检测工作发生了革命性变化。1994年,Ortho Clinical Diagnostics推出了第一台以CAT检测为基础的全自动血型分析仪AutoVue,在提高检测灵敏度的同时,减少人员干预和操作步骤,从根源上避免人为错误的发生,进一步的促进输血安全。
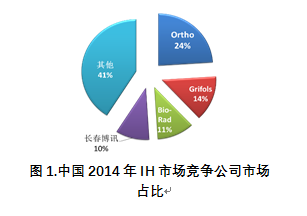
在中国,由于三级医院更倾向于选择质量优越的柱凝集技术检测方法,所以以提供CAT产品为主的4家IH试剂和器械企业在中国IH市场中占主导地位,其中3家为跨国企业,1家为本土企业。据Boston Biomedical consultants市场报告显示,2014年中国IH市场占比最大的为美国的Ortho Clinical Diagnostics公司,其市场份额占24%;另外两家跨国企业Grifold和Bio-Rad分别占14%和11%;排名第4的本土企业长春博讯市场占比10%。同时,随着国家2010~2015年863计划对免疫血液学检测行业研发的支持,一批本土企业也逐渐成长起来,主要包括力博、上海血液生物、生科、苏大赛尔等试剂供应商,以及澳斯帮、深圳爱康等器械供应商。他们共同致力于推动中国输血事业的取得更加长足的发展。
二、血源安全检测未来发展前景
近年来,随着以核酸检测为代表的分子生物学技术在血液筛查方面的应用,献血、输血以及血液制品安全性有了很大的提高。但因技术特点对实验室的要求,技术本身的操作等因素,对临床诊断带来一些困难。随着NAT技术不断成熟和完善,这一技术将在我国的血液中心、血库和血液制品生产企业会逐步得到广泛的应用和推广。我国已将NAT血筛纳入《全血及成分血质量要求》中,并且国家卫计委下发了《关于做好血站核酸检测工作的通知》,以及卫计委下发的《全面推进血站核酸检测工作实施方案(2013~2015年)》,要求实现血液核酸检测基本覆盖全国。随着我国经济水平的不断提升,核酸检测技术的不断进步,最大限度地保证血源头安全。
第七节 血源安全检测领域相关企业概述
为保障献血者和受血者的安全,献血者所捐献的血液需开展乙型肝炎病毒、丙型肝炎病毒、人类免疫缺陷病毒、梅毒螺旋体检测、丙氨酸氨基转移酶检测以及ABO血型、RH血型定型。根据筛查项目的对象和方法学不同,可以将诊断类厂家分为酶免类厂家、ALT检测的生化类厂家,以及涉及核酸检测的分子诊断类厂家。血液分为血站和血浆站两个系统,血站是卫计委下属事业单位,采集全血,而血浆站是市场化运作,有偿采集血浆,再分离成蛋白质制作成血液制品。因此,与血源安全检测相关的另一类企业就是血液制品企业及其下属的浆站。
备注:各厂家介绍来自各公司官网
一、诊断类厂家
从事血液血清学检测技术的厂家国内和国外有20家以上单位。
(一)酶免类厂家
根据来自中国食品药品检定研究院官方数据汇总,其中2015年数据指2015年1月1日-2015年12月31日和2016年数据指2016年1月1日-2016年11月30日,分别就乙肝表面抗原酶联免疫诊断试剂、丙型肝炎病毒抗体诊断试剂、人类免疫缺陷病毒诊断试剂和梅毒诊断试剂,这四项涉及血源安全检测项目的批批检数据得出以下的数据分析。
1、2016年酶免HBsAg数据分析主要结论:
科华在该项目的领导地位进一步巩固,占有率提高7.87%;市场集中度进一步提高,前六大品牌占有率由92.10%上升至93.70%;部分品牌退出竞争,由2015年的18家下降至2016年的13家;全国市场容量略有下降,由2015年的176306832人份降至2016年的170430432下降比例为-4.58%。
2、2016年酶免丙肝数据分析主要结论:
万泰在丙肝项目中排名第一,但2016年的占有率较2015年下降了2.88%;市场集中度进一步提高,前五大大品牌占有率由90.59%上升至92.63%;全国市场容量略有上升,由2015年的121792320人份上升至2016年的137198496,上升比例为12.65%。
3、2016年酶免HIV数据分析主要结论:
万泰在艾滋项目中排名第一,且2016年的占有率较2015年略有上升,上升幅度为0.22%;市场占有率超过10%的有三家,分别为万泰、丽珠和英科新创。全国市场容量略有下降,由2015年的146791008人份下降至2016年的138088704,下降比例为5.93%。
3、2016年酶免TP数据分析主要结论:
.万泰在艾滋项目中排名第一,但2016年的占有率较2015年略有下降,下降幅度为2.95%;市场占有率超过10%的有四家,分别为万泰、荣盛、科华和英科新创;全国市场容量略有下降,由2015年的172140880人份下降至2016年的168424180,下降比例为2.16%。
1、英科新创(厦门)科技有限公司
英科新创(厦门)科技有限公司成立于1989年,是国内最著名的体外诊断试剂厂家之一,专业从事体外诊断试剂的研发、生产和营销。获得厦门市重点工业企业,技术进步先进工业企业,福建省战略性新兴产业骨干企业等称号。
英科新创公司已成功开发了酶联免疫诊断试剂、胶体金快速诊断试剂、临床生物化学诊断试剂、血型检测试剂、易捷系列血糖仪、干式生化分析仪、血红蛋白分析仪等医疗器械及相应检测试剂等诊断产品。公司的销售网络覆盖全国各省市自治区,产品远销美国、欧洲、南美、非洲、中东和东南亚等八十多个国家与地区并受到广泛好评,主要产品还被列入世界卫生组织(WHO)和联合国儿童基金会等采购名录。
英科新创作为体外诊断试剂行业的领先品牌,将充分运用公司在体外诊断技术方面生产和开发上积累的经验和优势,在体外诊断技术领域,竭力为用户提供多种、完整的医疗和个人检测系统与服务。
2、潍坊三维生物工程集团有限公司
3V生物创建于1988年7月9日,位于山东省潍坊市国家级高新技术产业区内。3V生物厂区面积共245亩,建筑面积100000平方米,拥有国内同行业中最大的GMP生产车间,最大的动物实验基地,最大的生物实验室,并拥有二级放射性开放实验室。另3V生物建设并投入运行潍坊、青岛、北京3个免疫诊断技术研发中心。
3、北京科卫临床诊断试剂有限公司
北京科卫临床诊断试剂有限公司的前身是中国人民解放军302医院于1990年创办的北京科卫临床诊断试剂厂。302医院是全军传染病专科医院,汇集国内众多著名的临床和诊断专家教授。302医院将领先的技术成果和宝贵无形资产,大量注入了北京科卫临床诊断试剂厂。1992年总后卫生部批复,在此基础上成立“全军传染病诊断试剂质控中心”。
2004年1月1日,按照国家相关规定,由中国人民解放军总后卫生部批准,对原北京科卫临床诊断试剂厂进行了企业改制和资产重组,成立了具有现代企业机制的北京科卫临床诊断试剂有限公司。
2013年12月31日,通过股权变更,成为南通市伊士生物技术有限公司全资子公司,实现强强联合,合并后公司产品线实现酶免、化学发光、金标快诊、半自动仪器、全自动仪器的全面覆盖,同时将两个公司各具优势的海外市场、国内临床市场渠道优势进行整合,做到优势互补,为成为国内一流的体外诊断试剂生产、研发企业打下坚实的基础。
4、中山生物工程有限公司
公司成立于1991年7月3日,由中山医科大学(现中山大学)与中炬高新技术实业(集团)股份有限公司于联合创办“中山市中山生物工程公司”,1991年9月获得卫生部肝炎诊断试剂产品批准文号,并开始正式生产。1998年10月更名为“中山市中山生物工程有限公司”。2001年6月公司董事会决定将公司名称更改为现用名“中山生物工程有限公司”。2006年公司由原址“中山市火炬开发区沙边路5号”搬迁至现址“中山市火炬开发区国家健康基地生物谷大道1号”。2007年10月公司与中山大学达安基因股份有限公司实现股权并购,成为中山大学达安基因股份有限公司的全资独立子公司。
中山生物工程有限公司是一家生产和销售体外诊断试剂的高新技术企业。生产产品主要包括EB病毒检测试剂、乙型肝炎病毒检测试剂、甲型肝炎病毒检测试剂、G6PD检测试剂、丙型肝炎病毒检测试剂,艾滋病毒检测试剂等,详细名单见产品目录。正在申请注册的产品有血型卡仪器及试剂,降钙素原(PCT)检测试剂,登革热检测试剂等。经营各类临床检验分析仪器、体外诊断试剂,以及医疗器械软件等。
5、上海荣盛生物药业有限公司
公司成立于1991年7月3日,由中山医科大学(现中山大学)与中炬高新技术实业(集团)股份有限公司于联合创办“中山市中山生物工程公司”,1991年9月获得卫生部肝炎诊断试剂产品批准文号,并开始正式生产。1998年10月更名为“中山市中山生物工程有限公司”。2001年6月公司董事会决定将公司名称更改为现用名“中山生物工程有限公司”。2006年公司由原址“中山市火炬开发区沙边路5号”搬迁至现址“中山市火炬开发区国家健康基地生物谷大道1号”。2007年10月公司与中山大学达安基因股份有限公司实现股权并购,成为中山大学达安基因股份有限公司的全资独立子公司。
中山生物工程有限公司是一家生产和销售体外诊断试剂的高新技术企业。生产产品主要包括EB病毒检测试剂、乙型肝炎病毒检测试剂、甲型肝炎病毒检测试剂、G6PD检测试剂、丙型肝炎病毒检测试剂,艾滋病毒检测试剂等。正在申请注册的产品有血型卡仪器及试剂,降钙素原(PCT)检测试剂,登革热检测试剂等。经营各类临床检验分析仪器、体外诊断试剂,以及医疗器械软件等。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设