热门搜索:分会介绍 | 会员名单 | 行业资讯


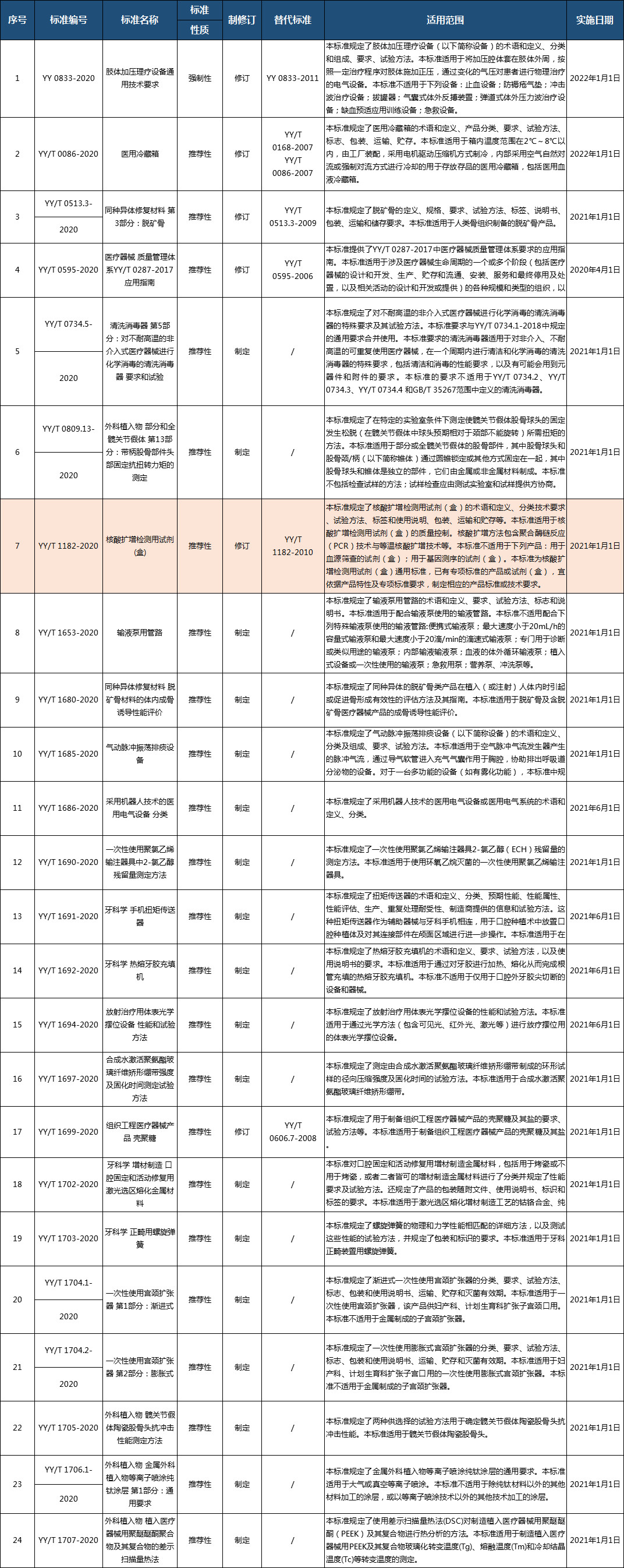
近日,国家药监局发布关于YY 0833-2020《肢体加压理疗设备通用技术要求》等24项医疗器械行业标准和6项修改单的公告(2020年 第20号)。其中,修订了核酸扩增检测用试剂(盒)体外诊断行业标准,此标准规定了核酸扩增检测用试剂(盒)的术语和定义、分类技术要求、试验方法、标签和使用说明、包装、运输和贮存等。此标准适用于核酸扩增检测用试剂(盒)的质量控制。核酸扩增方法包含聚合酶链反应(PCR)技术与等温核酸扩增技术等。此标准不适用于下列产品:用于血源筛查的试剂(盒);用于基因测序的试剂(盒)。此标准为核酸扩增检测用试剂(盒)通用标准,已有专项标准的产品或试剂(盒),宜依据产品特性及专项标准要求,制定相应的产品标准或技术要求,自2021年1月1日施行。详细点击下图查看。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设