
近日,信达生物制药宣布,与礼来共同开发的创新肿瘤药物信迪利单抗(达伯舒)正式获得国家药品监督管理局的批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗。
信达生物成为第二家PD-1单抗获批上市的本土创新药企,而信迪利单抗则是首个获批用于经典型霍奇金淋巴瘤的PD-1单抗。
关键临床数据
在2018年中国临床肿瘤学年会(CSCO),信达生物公布了信迪利单抗用于治疗复发/难治性经典型霍奇金淋巴瘤治疗的关键性ORIENT-1研究的结果:客观有效率高达80.4%,包括33.7%的患者肿瘤完全消失,疾病控制率97.9%。在安全性方面,与国外同类药物相似,没有非预期的不良事件发生。
临床设计:
信达组织开展的ORIENT-1研究纳入96例复发或难治性cHL患者,是迄今为止中国入组人数最多的复发或难治性cHL研究。
招募的96位放疗与自体干细胞移植(ASCT)在内的≥2线治疗失败的中国cHL患者,使用信迪利单抗注射液治疗,剂量200mg/人,三周一次。
临床数据:
经过IRRC评估,92例患者中有74位患者肿瘤明显缩小,达到客观缓解的标准,客观缓解率80.4%,其中包括33.7%的患者肿瘤完全消失。
副作用:
最常见治疗相关不良事件为发热(39/96,40.6%),多发生在首次注射并在1天内恢复;最常见免疫相关不良事件为甲状腺功能减退(19/96,19.8%)且均为1-2级。
肿瘤免疫疗法兴起
近年来,肿瘤免疫治疗已成为晚期恶性肿瘤治疗的重要手段之一。肿瘤免疫治疗并不直接攻击癌细胞,而是通过激活人体自身免疫系统来抗击肿瘤,具有良好的安全性及耐受性。PD-1/L1 抗体药物作为肿瘤免疫治疗的代表药物,在晚期恶性肿瘤治疗中取得了巨大的成功。
PD-1/L1 抗体药物目前也成为了各大制药企业的热门研究项目,目前国内包括信迪利单抗在内已有四款药物上市,还有更多药物研发和适应症开发在进行中。
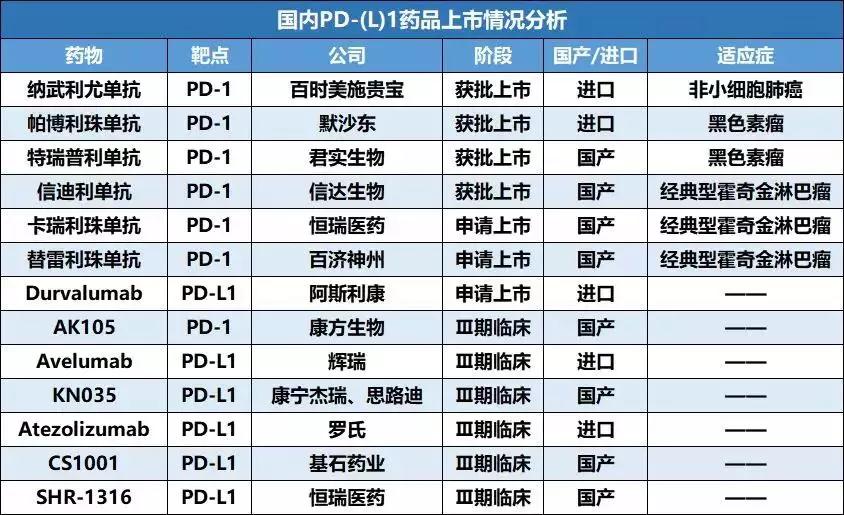
2018年12月26日,CDE已经受理Durvalumab上市申请,该药物是首个在国内申请上市的PD-L1单抗。
另根据CDE临床试验登记信息,目前,仍有7款国产/进口PD-(L)1抗体处于临床3期。从2/3临床登记号首次公示日期以及首批患者的入组日期,可以了解到罗氏Atezolizumab临床试验明显领先于其他PD-L1抗体,能够预见,罗氏PD-L1单抗也将在最近申请上市。
可瑞达、欧迪沃、Durvalumab等2019年将会有多个适应症获批或是递交上市申请。
2018年可谓是中国免疫疗法的转折年,免疫疗法实现0的突破。PD-(L)1抗体的上市给非小细胞肺癌、黑色素瘤治疗提供了新颖的治疗选择。
除了临床获益之外,药物的定价更为广大患者和医师关注,O药和K药两款药物的定价也已公布,特瑞普利单抗价格参考网传价格:
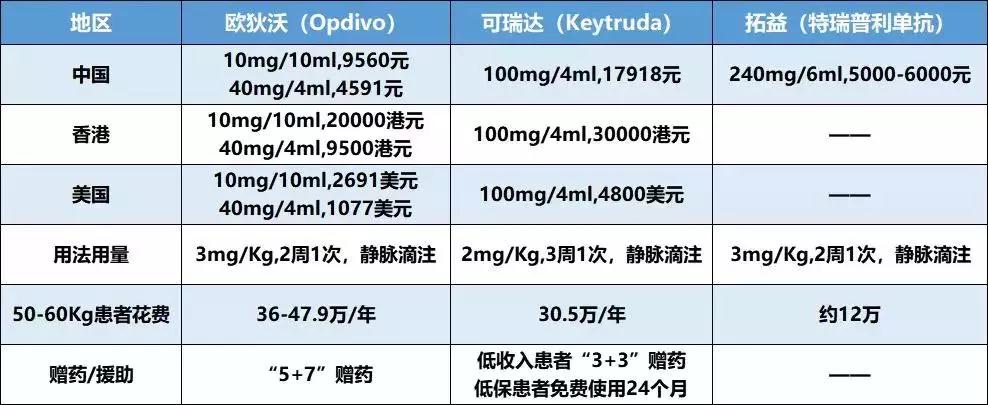
特瑞普利单抗具体定价尚未公布,网传240mg,5000-6000元,该价格与欧迪沃、可瑞达的赠药/援助后价格相比仍有一定优惠,定价已经比较低,后来者的降价空间已经比较小, 由此可见,中国PD-(L)1抗体市场已太过拥挤,价格战不是最终出路,无休止的价格战会让参与者拖入恶性竞争中。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设