
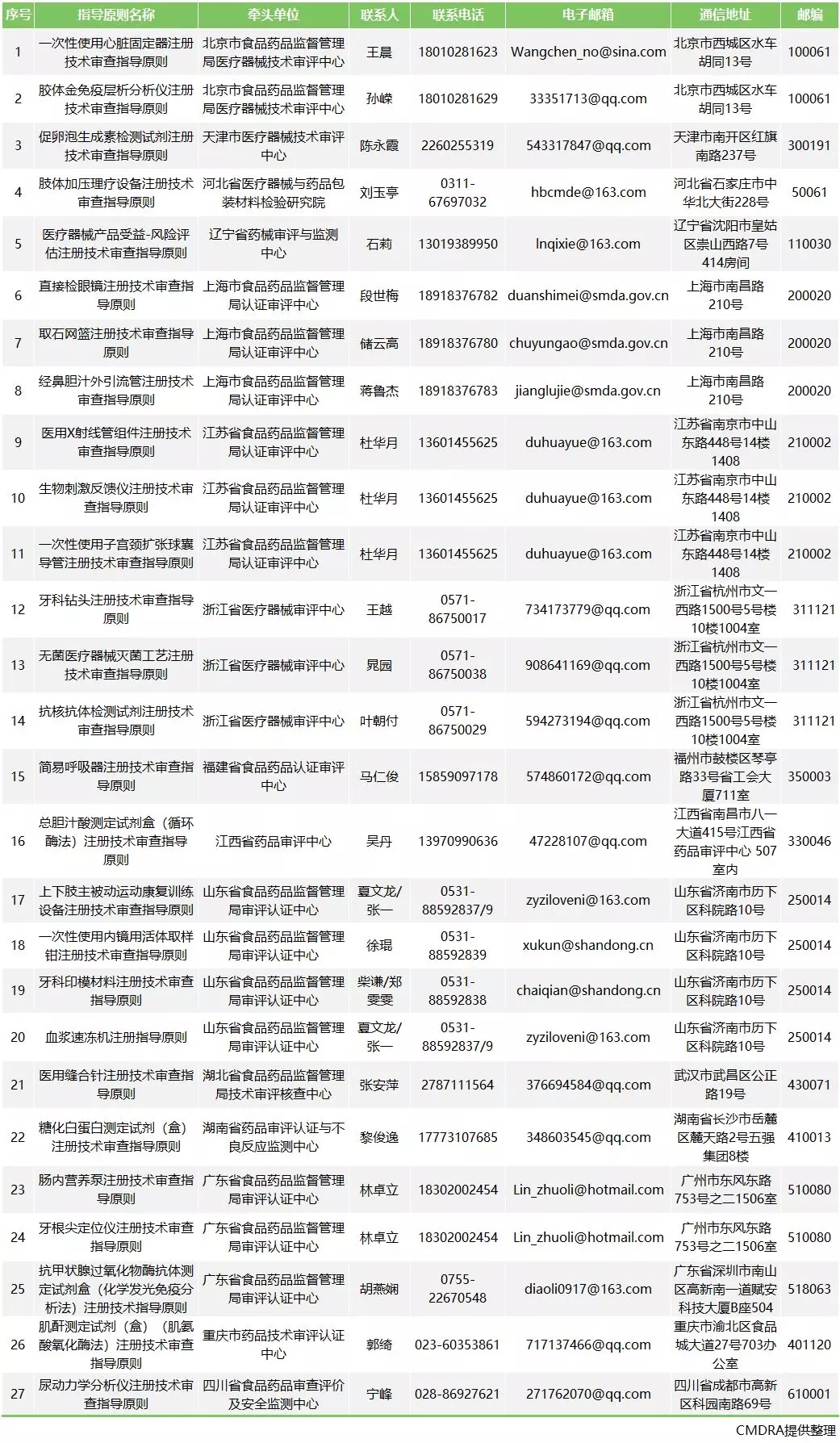
近日器审中心发布《关于2018年度第二类医疗器械注册技术审查指导原则公开征求意见的通知》,其中包括《一次性使用心脏固定器注册技术审查指导原则》等27个二类指导原则,小编将属于体外诊断类的产品和各项指导原则的适用范围罗列如下:
01胶体金免疫层析分析仪注册技术审查指导原则
适用范围:本指导原则适用于在医学实验室通过测定胶体金试剂卡反应区条带的反射率对样品结果进行判读的仪器。本指导原则不适用于采用荧光标记或其他标记方法进行快速免疫测定的仪器,但适用处可参照执行。
本指导原则适用于定量检测仪器,仅具有定性/半定量检测功能的仪器适用处可参照执行。
02促卵泡生成素检测试剂注册技术审查指导原则
适用范围:促卵泡生成素检测试剂用于体外定量检测人血液或其他体液样本中促卵泡生成素(Follicle-stimulating hormone,FSH)的含量。本指导原则适用于以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法为捕获抗体,以微孔板、管、磁颗粒、微珠和塑料珠等为载体包被抗体,定量检测FSH的免疫分析试剂,不适用于以胶体金标记的FSH定量检测试纸条、用放射性同位素标记的各类放射免疫或免疫放射检测试剂。根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),促卵泡生成素检测试剂应按照第二类医疗器械管理,分类代号为6840。
03医疗器械产品受益-风险评估注册技术审查指导原则
适用范围:本指导原则阐释了审评机构在医疗器械技术审评过程中需要进行受益-风险评估时应考虑的主要因素。本指导原则中讨论的概念适用于从设计到销售的医疗器械设计开发过程。因此,在设计、临床前测试、临床评价各阶段,应考虑本指导原则中规定的受益-风险因素。
04抗核抗体检测试剂注册技术审查指导原则
适用范围:本指导原则所述抗核抗体检测试剂是指利用间接免疫荧光法、酶联免疫吸附法、化学发光法、线性免疫印迹法等基于抗原抗体反应原理,针对人血清、血浆样本中总抗核抗体或针对靶抗原的特异性自身抗体进行体外定性和/或半定量和/或定量检测的试剂。同时,本指导原则是针对抗核抗体检测试剂的通用指导原则,申请人应结合具体产品的特点进行申报。如果申报产品有具体指导原则,应参照执行。
本指导原则适用于进行注册申请和相关许可事项变更的产品。依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)(以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),抗核抗体及针对靶抗原的特异性自身抗体检测试剂属于自身抗体检测试剂,管理类别为Ⅱ类6840。
05总胆汁酸测定试剂盒(酶循环法)注册技术审查指导原则
适用范围:本指导原则适用于基于酶循环法原理,利用全自动生化分析仪、半自动生化分析仪或分光光度计,体外定量测定人血清或血浆中总胆汁酸含量的测定试剂盒。本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
从方法学考虑,本指导原则适用于采用3α-羟基类固醇脱氢酶(3α-HSD)催化的酶促循环反应,利用全自动、半自动生化分析仪或分光光度计,在405nm波长附近测定生成的硫代还原型烟酰胺腺嘌呤二核苷酸(Thio-NADH)的吸光度变化,计算总胆汁酸含量的测定试剂(盒)。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),总胆汁酸检测试剂盒属于用于其他生理、生化或免疫功能指标检测的检测试剂,管理类别为二类,分类代码为6840。
06糖化白蛋白测定试剂(盒)注册技术审查指导原则
适用范围:依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),本指导原则适用于按Ⅱ类医疗器械管理的糖化白蛋白检测试剂(盒),产品类别为:Ⅱ-1用于蛋白质检测的试剂。
本指导原则适用于使用酶法对血清或血浆中的糖化白蛋白进行定量检测的试剂(盒),包括手工试剂和在半自动、全自动生化分析仪上使用的试剂。糖化白蛋白测定试剂(盒)如包含白蛋白测试组份,白蛋白测定试剂的要求参考《白蛋白测定试剂(盒)注册技术审查指导原则(2016年第29号)》
本指导原则不适用于干式化学测定试剂和POCT类试剂。
07抗甲状腺过氧化物酶抗体测定试剂盒(化学发光免疫分析法)注册技术审查指导原则
适用范围:从方法学考虑,在本文中抗甲状腺过氧化物酶抗体测定试剂是指采用化学发光免疫分析技术,利用全自动、半自动化学发光免疫分析仪,对人血清或血浆样本中抗甲状腺过氧化物酶抗体的含量进行体外定量分析的试剂。
根据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)和《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),抗甲状腺过氧化物酶抗体测定试剂的管理类别为二类,分类代码为6840。本指导原则适用于进行首次注册申报和相关许可事项变更的产品。
本指导原则不适用于:
(一)单独申请注册的抗甲状腺过氧化物酶抗体校准品和质控品。
(二)化学发光免疫分析法原理之外的其他抗甲状腺过氧化物酶抗体测定试剂盒。
08肌酐测定试剂(盒)(肌氨酸氧化酶法)注册技术审查指导原则
适用范围:肌酐测定试剂(盒)(肌氨酸氧化酶法)用于体外定量测定人血清、血浆或尿液中的肌酐含量。
本指导原则仅适用于采用肌氨酸氧化酶法,利用全自动、半自动生化分析仪或分光光度计,在医学实验室进行肌酐定量测定所使用的临床化学体外诊断试剂。基于其他酶法的肌酐测定试剂盒可参照本指导原则,但应根据产品的具体特性确定其中的内容是否适用,若不适用,应另外选择适合自身方法学特性的研究步骤及方法。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号),肌酐检测试剂(盒)(肌氨酸氧化酶法)管理类别为Ⅱ类。
09尿动力学分析仪注册技术审查指导原则
适用范围:本指导原则适用于临床常规尿动力学检查用尿动力学分析仪,该设备通过对下尿道的压力、尿流量和肌电特性的定量、定性分析,用于评估患者下尿路尿控机能,如膀胱过度活动症、排尿不畅、尿路梗阻、尿失禁、脊髓损伤、逼尿肌尿道括约肌协同失调、膀胱出口梗阻、神经源性膀胱尿道功能障碍。
根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017第104号),尿动力学分析仪的管理类别为二类,分类编码为07(医用诊察和监护器械)—09(其他测量、分析设备)—01(泌尿、消化动力学测量、分析设备)。
尿流计,尿流量仪可参考本指导原则的适用部分。
如果尿动力学分析仪在常规尿动力学检查基础上扩展了其他检查项目,则本指导原则也适用于其常规尿动力学检查部分。
以下是27个II类医疗器械
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设