热门搜索:分会介绍 | 会员名单 | 行业资讯

国内篇
根据财政部和国家发展改革委发布的《关于重新发布中央管理的食品药品监督管理部门行政事业性收费项目的通知》和《关于印发〈药品、医疗器械产品注册收费标准管理办法〉的通知》,CFDA制定并发布了《医疗器械产品注册收费实施细则(试行)》,收费自2015年5月27日起施行。这一举措重新开启了医疗器械产品注册收费新时代。
截至2018年5月,共有24个省发布了医疗器械注册收费标准。
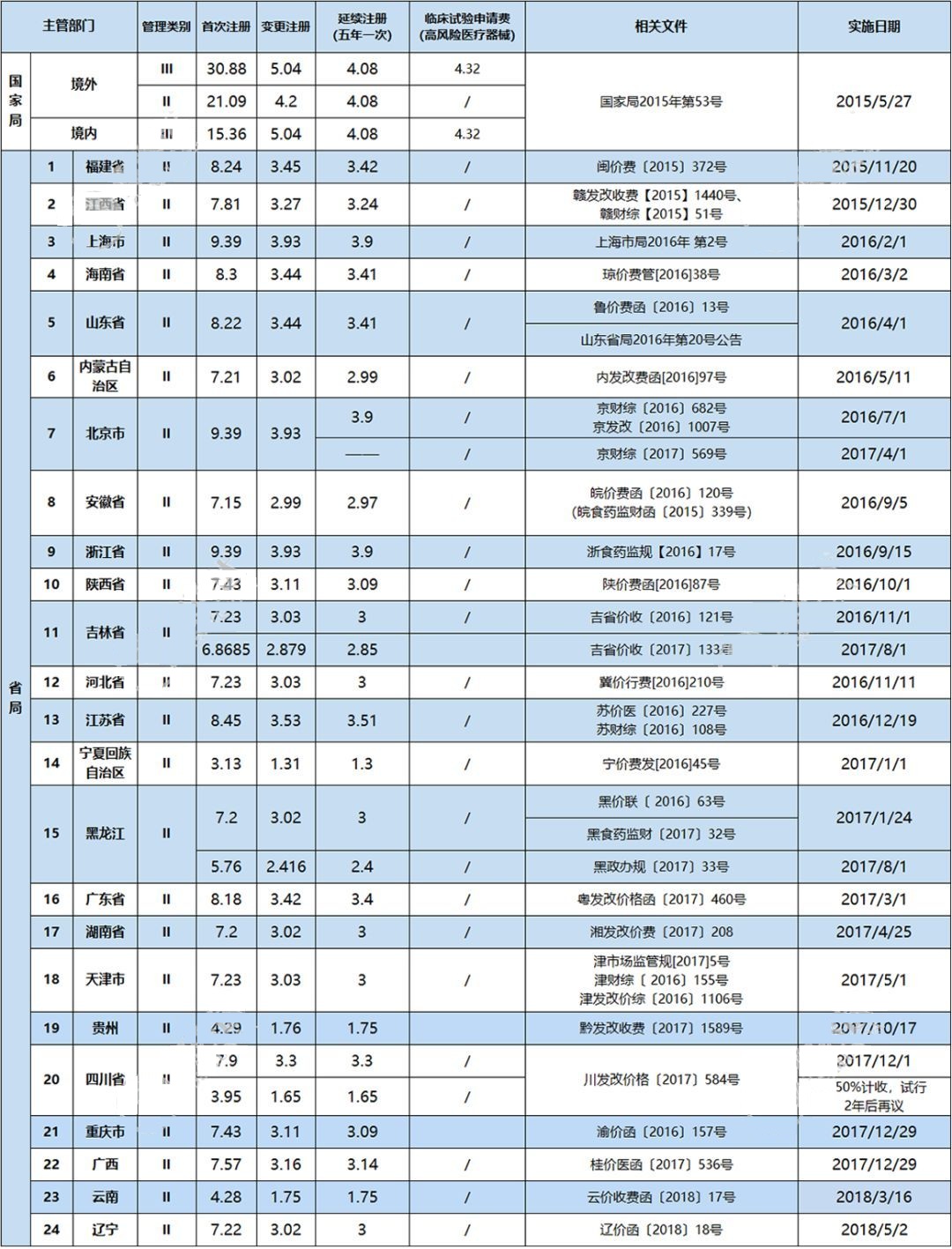
单位:万元
FDA篇
就在2018年7月30日,FDA发布了其2019财年收费标准。
其中,与医疗器械有关的收费如下:
对于提交申请的小型企业,FDA依据采取减免政策(小型企业的定义标准与2018年要求一致)
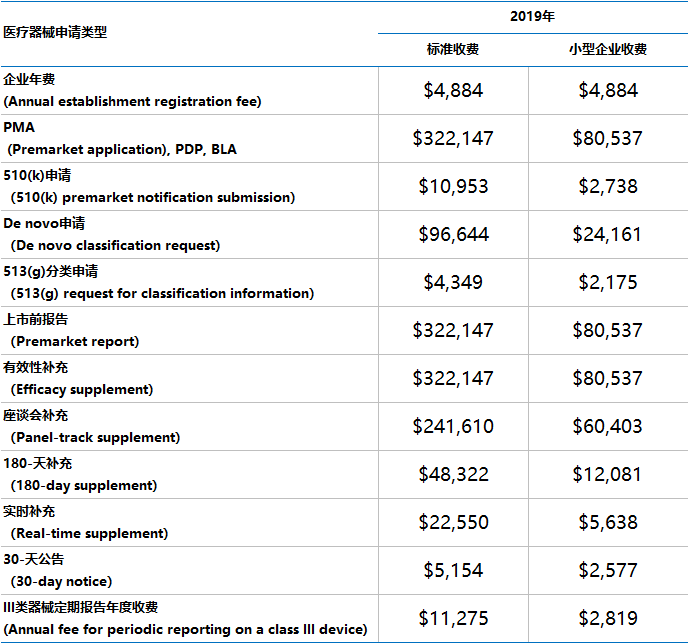
注:2019财年计为2018年10月1日至2019年9月30日。
较之2018年,申请项目收费涨幅图示如下:
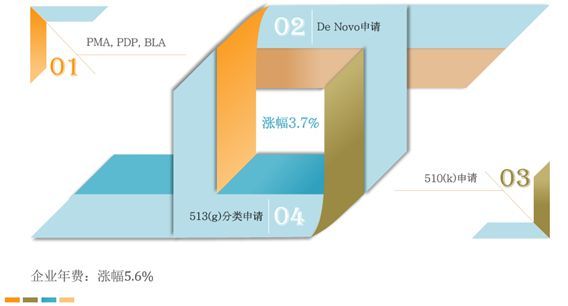
具体如下表:
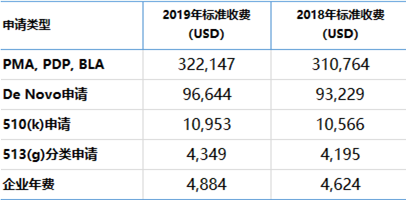
注: 2019财年计为2018年10月1日至2019年9月30日;
2018财年计为2017年10月1日至2018年9月30日。
在不断更新的法规、收费、标准等,在上一年蓝皮书已做了专业点评和整理。

光阴似箭,在2018已过半的日子里,奥咨达将秉持着共享学习、海纳百川的态度,全面整理新一年的医疗器械行业蓝皮书。

邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设