
近期,国家食品药品监督管理总局按照《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号)要求,组织开展了2017年医疗器械生产企业飞行检查工作。据食药总官网公布的飞行检查名单中,限期整改企业有5家,分别为广东省2家、山东省2家、安徽1家,甘肃省属跟踪检查。
医疗设备质量与安全性对医疗诊断、治疗、以及患者的生命健康有十分重要的影响。但是有些械企为节约成本,铤而走险忽视器械产品质量、简化灭菌环节。在安全设施设备方面要么缺少、要么根本不建设不安装。医疗器械质量事故主要是指其质量不符合注册产品标准等规定造成的事故,致使患者死亡或者严重危害健康的情况。为此国家对医疗器械的监管也比其他产品严格得多,为蝇头小利导致限期整改、停产整顿,最终受伤害的是不幸的患者,受损失的是企业自身。以下是为您汇总的本次食药总局飞行检查中被点名的6家企业名单。
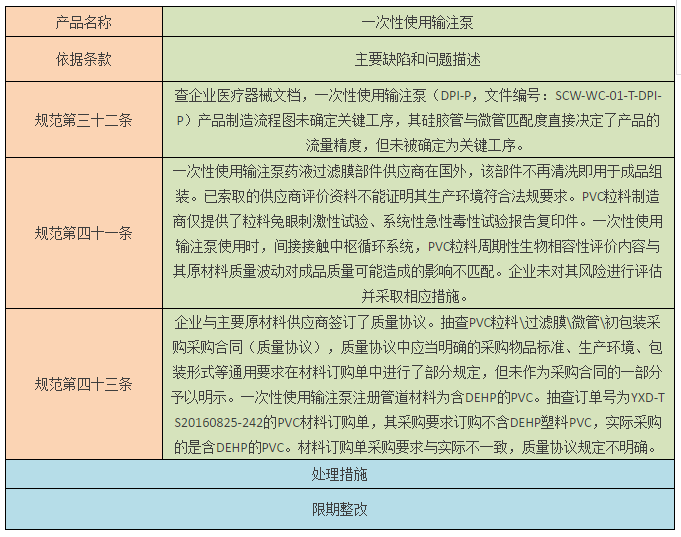
一、限期整改:深圳市益心达医学新技术有限公司
针对深圳市益心达医学新技术有限公司检查中发现的问题,责成企业限期整改,必要时跟踪复查,评估产品安全风险,对有可能导致安全隐患的,应按照《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号)的规定,召回相关产品。企业完成整改后,将情况及时上报总局医疗器械监管司。
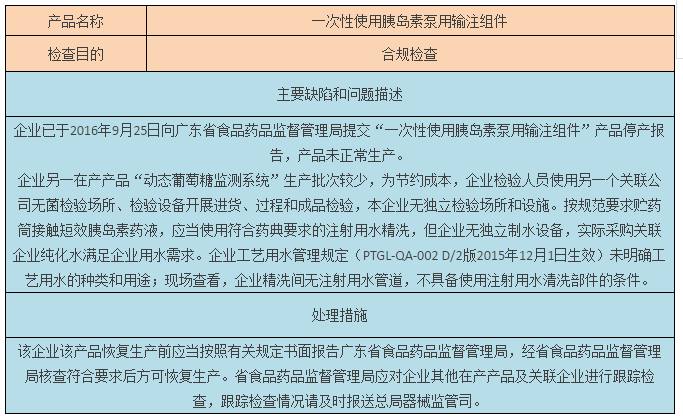
二、限期整改:普林斯顿医疗科技(珠海)有限公司
针对普林斯顿医疗科技(珠海)有限公司的检查中发现,该企业已于2016年9月25日向你局提交“一次性使用胰岛素泵用输注组件”产品停产报告,产品未正常生产,但同一厂房“动态葡萄糖监测系统”产品处正常生产状态。
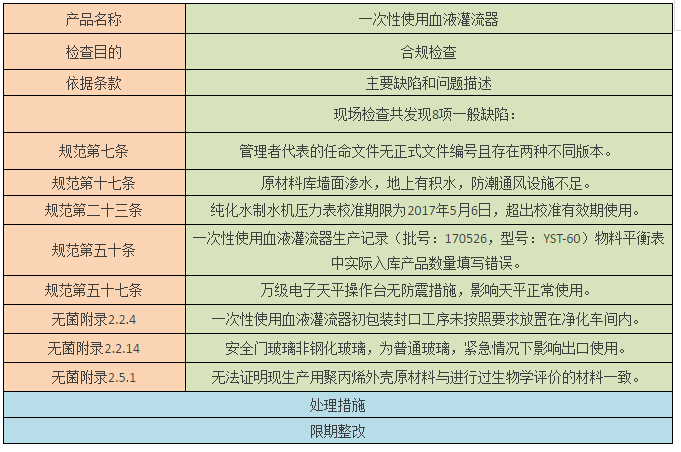
三、限期整改:淄博康贝医疗器械有限公司
针对淄博康贝医疗器械有限公司和山东侨牌集团有限公司检查中发现的问题,责成企业限期整改,必要时跟踪复查,评估产品安全风险,对有可能导致安全隐患的,应按照《医疗器械召回管理办法》(国家食品药品监督管理总局令第29号)的规定,召回相关产品。企业完成整改后,将情况及时上报总局医疗器械监管司。
四、山东侨牌集团有限公司检查情况表

五、限期整改:安徽康泰医疗器具有限公司
针对安徽康泰医疗器具有限公司检查中发现的问题,已由检查组告知你局派出的观察员。现请你局根据检查中发现的问题(详见附件),进一步做好以下工作:

六、跟踪检查:甘肃辰旭医疗科技有限公司
针对甘肃辰旭医疗科技有限公司检查中发现,该企业已于2013年1月停产。检查情况(详见附件)已由检查组告知你局派出的观察员。该企业恢复生产前应当按照有关规定书面报告你局,经你局核查符合要求后方可恢复生产,并请你局将企业恢复生产相关情况及时报送总局医疗器械监管司。

邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设