
全国医用临床检验实验室和体外诊断系统标准化技术委员会(SAC/TC136)由国家标准化管理委员会批准成立于1988年,是我国负责临床检验实验室质量和能力、参考测量系统和体外诊断系统标准化工作的技术机构,对口国际标准化组织ISO/TC 212 Clinical laboratory testing and in vitro diagnostic test systems(临床实验室检测和体外诊断试验系统),标委会秘书处设在北京市医疗器械检验所。目前为第五届,共84名委员,由来自体外诊断生产企业、医疗机构、科研院所、行业监管等领域的专家组成。截止到2016年底,归口发布的国家标准16项(见附表1),行业标准171项(见附表2)。
一、开展标准清理评估、复审整合工作
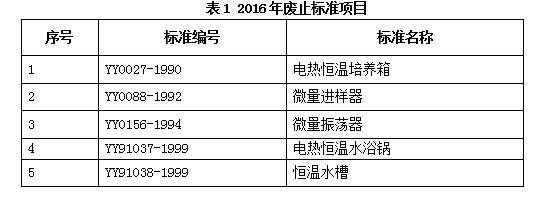
标准化在保障产品质量安全、促进产业转型升级和经济提质增效、服务外交外贸等方面起着越来越重要的作用。随着我国经济社会发展日益增长的需求,为贯彻落实《中共中央关于全面深化改革若干重大问题的决定》、《国务院机构改革和职能转变方案》和《国务院关于促进市场公平竞争维护市场正常秩序的若干意见》,更好地发挥标准化在推进国家治理体系和治理能力现代化中的基础性、战略性作用,促进经济持续健康发展和社会全面进步,国务院发布了《关于印发深化标准化工作改革方案的通知》(国发〔2015〕13号),提出了深化标准化工作改革、加强技术标准体系建设的有关要求。为贯彻实施《深化标准化工作改革方案》,协同有序推进标准化工作改革,2016年国家标准化管理委员会下达了开展强制性标准整合精简、推荐性标准集中复审等任务。SAC/TC136按照国家标准化管理委员会、国家食品药品监督管理总局、国家食品药品监督管理总局医疗器械标准管理中心的要求和程序,对归口的强制性标准和推荐性标准(含计划项目)进行了分析、研究、论证,提出了评估和复审结论,并报上级主管部门。其中,对于5项标准给出了废止的意见并获批准,见表1。
二、2016年制修订的国家标准、行业标准项目
2016年度SAC/TC136共承担了7项国家标准、19项行业标准的组织制修订任务,标准目录见表2。其中,有6项标准的文件基础是中国合格评定国家认可委员会(CNAS)制定的应用指南,是从认可文件上升到国家标准,并与GB/T 22576.1《医学实验室 质量和能力的要求》形成系列标准。

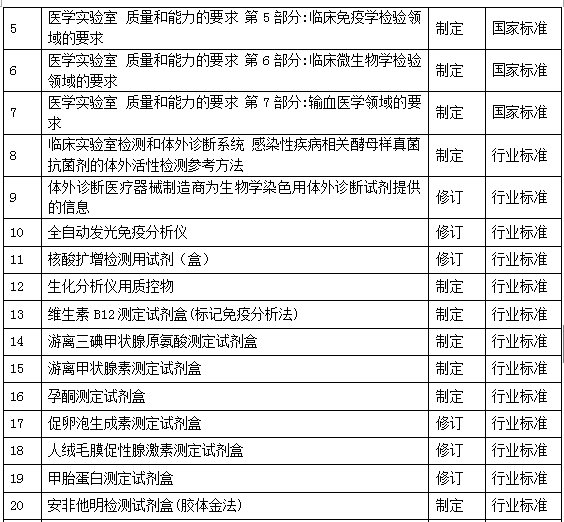

下面对26项标准逐一进行介绍:
1、体外诊断医疗器械 生物源性样品中量的测量 参考测量程序的表述和内容的要求(ISO 15193:2009,IDT)(修订项目,修订GB/T 19702—2005)
主要内容:本标准规定了体外诊断医疗器械和医学实验室使用的参考测量程序内容的要求。
适用范围:本标准适用于提供差示值或比例量值的参考测量程序。本标准适用于在检验医学各个学科分支中,需要编写参考测量程序文件的所有个人、机构或研究所。完整描述的测量方法通常发表在科学文献上,这些充分详细描述的方法可以作为文件化参考测量程序的基础。
2、医学实验室 质量和能力的要求 第2部分:临床血液学检验领域的要求
主要内容:本文件规定了医学实验室质量和能力的要求在临床血液学检验领域的要求。临床血液学检验领域包括血细胞分析、血细胞形态学检查、血液寄生虫检查及出凝血检验等。
适用范围:本部分是GB/T 22576.1在临床血液学检验领域的具体要求,与GB/T 22576.1共同使用。。
3、医学实验室 质量和能力的要求 第3部分:尿液检验领域的要求
主要内容:本文件规定了医学实验室的质量和能力要求在尿液一般检验领域的要求。
适用范围:本部分是GB/T 22576.1在尿液检验领域的具体要求,与GB/T 22576.1共同使用。
4、医学实验室 质量和能力的要求 第4部分:临床化学检验领域的要求
主要内容:本文件规定了医学实验室的质量和能力的要求在临床化学检验领域的要求,以及在临床免疫学定量检验领域的要求。
适用范围:本部分是GB/T 22576.1在临床化学专业领域的具体要求,与GB/T 22576.1共同使用。
5、医学实验室 质量和能力的要求 第5部分:临床免疫学检验领域的要求
主要内容:本文件规定了医学实验室质量和能力的要求在临床免疫学定性检验领域的要求,临床免疫学定量检验领域的要求见GB/T 22576.4《医学实验室 质量和能力的要求 第4部分:临床化学检验领域的要求》。
适用范围:本部分是GB/T 25776.1在临床免疫学检验领域的具体要求,与GB/T 22576.1共同使用。
6、医学实验室 质量和能力的要求 第6部分:临床微生物学检验领域的要求
主要内容:本标准规定了临床微生物学检验实验室的质量和能力要求。
适用范围:本标准适用于临床微生物学检验实验室。本标准不适用于临床微生物学检验中涉及的病毒血清学检验、基因检验、寄生虫检验。本部分是GB/T 22576.1在临床微生物学检验领域的具体要求,与GB/T 22576.1共同使用。
7、医学实验室 质量和能力的要求 第7部分:输血医学领域的要求
主要内容:本标准规定了医学实验室质量和能力的要求在输血医学领域的要求。
适用范围:本标准适用于医疗机构的输血相容性检测实验室和血站的血型参比实验室及血液检测实验室的血型检测部分。本部分是GB/T 22576.1在输血医学领域的具体要求,与GB/T 22576.1共同使用。
8、临床实验室检测和体外诊断系统 感染性疾病相关酵母样真菌抗菌剂的体外活性检测参考方法(ISO 16256,IDT)
主要内容:本标准描述了检测酵母样真菌抗真菌药物的敏感性的方法,包括引起感染的念珠菌属和新型隐球菌。这里描述的参考方法还未用于双相型真菌的酵母型菌研究。如皮炎芽生菌和/或荚膜组织胞浆菌荚膜变种。另外在检测丝状真菌(霉菌)标准化中涉及几个未在当前程序阐述的其他问题。丝状真菌肉汤稀释法抗真菌剂药敏试验参考方法已经制订。
9、体外诊断医疗器械 制造商为生物学染色用体外诊断试剂提供的信息(ISO19001:2013,IDT)(修订项目,修订YY/T 0639-2008)
主要内容:本标准规定了制造商为生物学染色用试剂所提供信息的要求
适用范围:本标准适用于染料,染色剂、显色试剂和其他用于组织学和细胞学染色(微生物学,血液学、组织化学)的生产者、供应商和零售商。这些试剂用于医学实验室进行常规染色,和微生物学研究在生物染色所有领域中,本标准所规定的制造商提供信息的要求,是获得可参照和可复现结果的先决条件。
10、全自动发光免疫分析仪(修订项目,修订YY/T 1155-2009)
主要内容:本标准规定了全自动发光免疫分析仪的要求、试验方法、标签、标记和使用说明书、包装、运输和贮存。
适用范围:本标准适用于医学实验室使用的全自动发光免疫分析仪。分析仪采用发光系统和免疫分析方法对人类血清、血浆或其它体液中的各种被分析物进行定量或定性检测,包括基于化学发光、电化学发光、荧光等原理的发光免疫分析仪。本标准不适用于:a)基于图像识别的发光免疫分析仪;b)即时即地检验(POCT)的全自动发光免疫分析仪。
11、核酸扩增检测用试剂(盒)(修订项目,修订YY/T 1182-2010)
主要内容:本标准规定了核酸扩增检测用试剂(盒)的术语和定义、技术要求、试验方法、标签与使用说明、包装、运输和贮存等。
适用范围:本标准适用于核酸扩增检测用试剂(盒)的质量控制。核酸扩增方法包含聚合酶链反应(PCR)技术与等温核酸扩增技术等。本标准不适用于下列产品:a)用于血源筛查的试剂(盒);b)用于基因测序的试剂(盒)。本标准为核酸扩增检测用试剂(盒)通用标准,已有专项标准的产品或试剂(盒),宜依据产品特性,及专项标准要求,制定相应的产品标准或技术要求。
12、生化分析仪用质控物
主要内容:本标准规定了在生化分析仪上使用的质控物的要求,内容包括要求、试验方法、标签、使用说明书、包装、运输和贮存等。
适用范围:本标准适用于预期用于实验室内部质量控制目的的带有可接受区间/值的质控物。非定值质控物可以参照本标准中的适用条款。
13、维生素B12测定试剂盒(标记免疫分析法)
主要内容:本标准规定了人维生素B12定量标记免疫分析试剂盒的分类、要求、试验方法、标识、标签、使用说明书、包装、运输和贮存。
适用范围:本标准适用于体外定量检测人血清或血浆中维生素B12的含量的免疫分析试剂盒。本标准不适用于:a)用胶体金或其它方法标记的定性或半定量测定人维生素B12的试剂(如:试纸条、生物芯片等);b)拟用于单独销售的维生素B12校准品和维生素B12质控品。
14、游离三碘甲状腺原氨酸测定试剂盒
主要内容:本标准规定了游离三碘甲状腺原氨酸测定试剂盒的分类、要求、试验方法、标签和使用说明、包装、运输和贮存。
适用范围:本标准适用于以酶标记、(电)化学发光标记、(时间分辨)荧光标记等方法,采用竞争法为原理体外定量测定游离三碘甲状腺原氨酸(FT3)的免疫分析试剂盒。 本标准不适用于:a)用胶体金或其它方法标记的定性或半定量测定人游离三碘甲状腺原氨酸的试剂(如:试纸条、生物芯片等);b)用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒;c)拟用于单独销售的游离甲状腺素校准品和游离甲状腺素质控品,或FT3试剂盒中的校准品和质控品。
15、游离甲状腺素测定试剂盒
主要内容:本标准规定了游离甲状腺素测定试剂盒的分类、要求、试验方法、标签和使用说明、包装、运输和贮存。
适用范围:本标准适用于以酶标记、(电)化学发光标记、(时间分辨)荧光标记等方法,采用双抗夹心法或竞争法为原理体外定量测定游离甲状腺素(FT4)的免疫分析试剂盒。 本标准不适用于:a)用胶体金或其它方法标记的定性或半定量测定人游离甲状腺素的试剂(如:试纸条、生物芯片等);b)用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒;c)拟用于单独销售的游离甲状腺素校准品和游离甲状腺素质控品,或FT4试剂盒中的校准品和质控品。
16、孕酮测定试剂盒
主要内容:本标准规定了孕酮测定试剂盒的要求、试验方法、标签、使用说明书以及包装、运输、贮存。
适用范围:本标准适用于进行孕酮测定的试剂盒,包括以酶标记、化学发光标记等方法定量测定孕酮的免疫分析测定试剂盒。本标准不适用于用胶体金或其它方法标记的定性或半定量测定孕酮的试剂(如:试纸条、生物芯片等)。
17、促卵泡生成素测定试剂盒
主要内容:本标准规定了促卵泡生成素测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输、贮存。
适用范围:本标准适用于以双抗体夹心法为原理定量测定促卵泡生成素的试剂盒,包括以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法的免疫分析试剂盒。本标准不适用于:用胶体金或其它方法标记的半定量测定促卵泡生成素的试剂(如:试纸条等);用125I等放射性同位素标记的各类促卵泡生成素放射免疫或免疫放射试剂盒。
18、人绒毛膜促性腺激素测定试剂盒
主要内容:本标准规定了人绒毛膜促性腺激素测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输、贮存。
适用范围:本标准适用于以双抗体夹心法为原理定量测定人绒毛膜促性腺激素的试剂盒,包括以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法的免疫分析试剂盒。本标准不适用于:用胶体金或其它方法标记的半定量测定人绒毛膜促性腺激素的试剂(如:试纸条等);用125I等放射性同位素标记的各类人绒毛膜促性腺激素放射免疫或免疫放射试剂盒。
19、甲胎蛋白测定试剂盒
主要内容:本标准规定了甲胎蛋白标记免疫测定试剂产品的分类、要求、检验方法、标示、标签、使用说明书、包装、运输和贮存等。
适用范围:本标准适用于以标记免疫测定为原理检测人血液基质或其它体液成分中的甲胎蛋白(AFP) 定量测定试剂,包括以酶、化学发光、荧光物等方法标记捕获抗体,以微孔板、管、磁颗粒、微珠和塑料珠、微流控芯片、纳米材料等为载体包被抗体定量测定AFP的免疫测定试剂盒。本标准不适用于:a)胶体金标记AFP试纸条;b)用125I等放射性同位素标记的各类放射免疫。
20、安非他明检测试剂盒(胶体金法)
主要内容:本标准规定了安非他明检测试剂盒(胶体金法)标准的术语和定义、要求、试验方法、标签和使用说明书、及包装、运输和贮存等。
适用范围:本标准适用于通过胶体金免疫层析法原理,定性检测人体尿液中安非他明(Amphetamine,AMP)的检测试剂盒及包含安非他明的联合检测试剂盒。本标准不适用于:a)进行非人尿液检测的检测试剂盒;b)采用其他方法检测的试剂盒。
21、ABO反定型检测卡(柱凝集法)
主要内容:本标准规定了ABO反定型检测卡(柱凝集法)的要求、试验方法、标签和说明书、包装、运输、贮存。
适用范围:本标准适用于使用凝胶、玻璃微珠等材料进行填充微柱,以免疫血液学、颗粒过筛和离心技术三者结合为原理,进行临床红细胞ABO血型系统的反定型检测的诊断试剂。本标准不适用用于血源筛查进行ABO血型系统的反定型检测的诊断试剂。
22、肺炎衣原体IgG抗体检测试剂盒(酶联免疫吸附法)
主要内容:本标准规定了肺炎衣原体IgG抗体检测试剂盒(酶联免疫吸附法)的要求、试验方法、标签和使用说明书以及包装、运输和贮存。
适用范围:本标准适用于采用酶联免疫吸附法,定性检测人体血清或血浆中肺炎衣原体IgG抗体的检测试剂盒。
23、胰岛素样生长因子I测定试剂盒
主要内容:本标准规定了胰岛素样生长因子I测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输、贮存。
适用范围:本标准适用于以双抗体夹心法为原理定量测定胰岛素样生长因子I的试剂盒,包括以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法的免疫分析试剂盒。本标准不适用于:a)用胶体金或其它方法标记的半定量测定胰岛素样生长因子I的试剂(如:试纸条等);b)用125I等放射性同位素标记的各类胰岛素样生长因子I放射免疫或免疫放射试剂盒。
24、甲状旁腺激素测定试剂盒
主要内容:本标准规定了甲状旁腺激素(Parathyroid Hormone,PTH)测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输、贮存。
适用范围:本试剂盒适用于双抗体夹心法为原理定量测定全段甲状旁腺激素(1~84)的试剂盒,包括以酶标记、(电)化学发光标记、(时间分辨)荧光标记等标记方法的免疫分析试剂盒。本标准不适用于:a)用胶体金或其它方法标记的半定量测定全段甲状旁腺激素(1~84)的试剂(如:试纸条等);b)用125I等放射性同位素标记的各类甲状旁腺激素放射免疫或免疫放射试剂盒。
25、人细小病毒B19 IgG抗体检测试剂盒
主要内容:本标准规定了人细小病毒B19 IgG抗体检测试剂盒(以下简称“试剂盒”)的要求、试验方法、标签和使用说明书、包装、运输和贮存。
适用范围:本标准适用于以酶联免疫法、化学发光法等为原理,定性检测人体血清/血浆中人细小病毒B19 IgG抗体的试剂盒。
26、胃蛋白酶原I/II测定试剂盒
主要内容:本标准规定了测定试剂盒的分类、要求、试验方法、标签和使用说明书、包装、运输和贮存。
适用范围:本标准适用于进行胃蛋白酶原I和胃蛋白酶原II测定试剂盒。包括以酶标记、化学发光标记等标记方法免疫分析试剂盒。本标准不适用于: a)胶体金标记或其它方法标记的半定量测定PGI/II试剂(如:试纸条等);b)用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
三、2016年发布的国家标准、行业标准
2016年国家食品药品监督管理总局发布2016年第25号文、第74号文和第129号文,共发布了23项体外诊断产品相关行业标准,见表3。
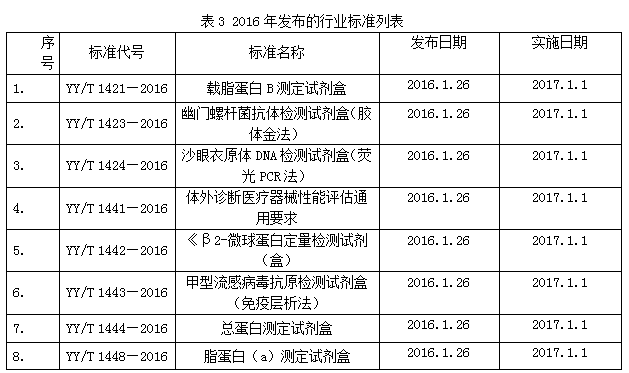
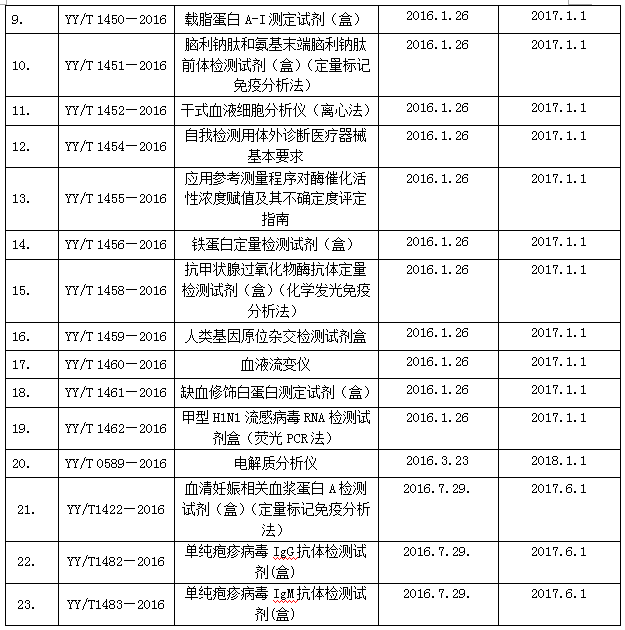
下面对23项标准逐一进行介绍:
1、YY/T 1421—2016《载脂蛋白B测定试剂盒》
本标准规定了载脂蛋白B测定试剂盒的要求、试验方法、标识、标签和使用说明书、包装、运输和贮存等要求。本标准适用于免疫比浊法(透射法)对人血清或血浆中的载脂蛋白B进行定量检测的试剂盒,包括手工和半自动、全自动生化分析仪上使用的试剂。
2、YY/T 1423—2016《幽门螺杆菌抗体检测试剂盒(胶体金法)》
本标准规定了幽门螺杆菌抗体检测试剂盒(胶体金法)的术语和定义、要求、试验方法、标识、标签、使用说明书、包装、运输和贮存等。本标准适用于以胶体金法为原理,定性检测人血清或血浆中幽门螺杆菌抗体的试剂盒的质量控制。
3、YY/T 1424—2016《沙眼衣原体DNA检测试剂盒(荧光PCR法)》
本标准规定了沙眼衣原体DNA检测试剂盒(荧光PCR法)的要求、试验方法、标识、标签、使用说明书、包装、运输和贮存等。本标准适用于以荧光PCR法为原理,定性检测人泌尿生殖道分泌物等临床样本中沙眼衣原体DNA的试剂盒。
4、YY/T 1441—2016《体外诊断医疗器械性能评估通用要求》
本标准规定了制造商在体外诊断医疗器械性能评估研究中对研究计划、实施、评估和制定文件的职责和总体要求。本标准适用于对体外诊断医疗器械的性能评估。本标准不适用于对某一特定体外诊断医疗器械或某一具体用途的评估方案。
5、YY/T 1442—2016《β2-微球蛋白定量检测试剂(盒)》
本标准规定了β2-微球蛋白定量检测试剂(盒)的要求、试验方法、标识、标签、使用说明书、包装、运输和贮存。本标准适用于以抗原-抗体反应为基本原理的定量检测血液样本或尿液样本中β2-微球蛋白的试剂(盒),包含定量标记免疫方法[如酶联免疫吸附法(ELISA)、时间分辨荧光免疫分析法、(电)化学发光法等]和免疫比浊法(包括免疫透射比浊法、胶乳增强免疫比浊法)。本标准不适用于对β2-微球蛋白校准品和质控品的评价。
6、YY/T 1443—2016《甲型流感病毒抗原检测试剂盒(免疫层析法)》
本标准规定了甲型流感病毒抗原检测试剂盒(免疫层析法)的术语和定义、要求、实验方法、标识、标签、使用说明书、包装、运输和贮存。本标准适用于通过胶体金或乳胶颗粒等免疫层析法原理,定性检测呼吸道分泌物及其培养物中的甲型流感病毒,以快速检出甲型流感病毒抗原的诊断试剂盒。本标准不适用于以酶相关的免疫层析法等为基本原理,用于甲型流感辅助诊断的试剂盒。
7、YY/T 1444—2016《总蛋白测定试剂盒》
本标准规定了总蛋白测定试剂盒(双缩脲法)的要求、试验方法、标签、使用说明书、包装、运输和贮存等。本标准适用于使用双缩脲法对人血清(血浆)中总蛋白进行定量检测的试剂盒,基于分光光度法原理,包括手工试剂和在半自动、全自动生化分析仪上使用的试剂。本标准不适用于干化学方法的总蛋白测定试剂盒。
8、YY/T 1448—2016《脂蛋白(a)测定试剂盒》
本标准规定了脂蛋白(a)测定试剂盒的要求、试验方法、标识、标签和使用说明书、包装、运输和贮存等要求。本标准适用于免疫比浊法(透射法)对人血清或血浆中的脂蛋白(a)进行定量检测的试剂盒,包括手工试剂和在半自动、全自动生化分析仪上使用的试剂。
9、YY/T 1450—2016《载脂蛋白A-I测定试剂(盒)》
本标准规定了载脂蛋白A-I测定试剂(盒)的要求、试验方法、标识、标签和使用说明书、包装、运输和贮存等要求。本标准适用于免疫比浊法(透射法)对人血清或血浆中的载脂蛋白A-I进行定量检测的试剂(盒),包括手工和半自动、全自动生化分析仪上使用的试剂。
10、YY/T 1451—2016《脑利钠肽和氨基末端脑利钠肽前体检测试剂(盒)(定量标记免疫分析法)》
本标准规定了脑利钠肽和氨基末端脑利钠肽前体检测试剂(盒)(定量标记免疫分析法)的要求、试验方法、标识、标签、使用说明书、包装、运输和贮存。本标准适用于对脑利钠肽进行定量检测的试剂(盒)、对氨基末端脑利钠肽前体进行定量检测的试剂(盒)。本标准不适用于各类胶体金标记试纸和用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
11、YY/T 1452—2016《干式血液细胞分析仪(离心法)》
本标准规定了干式血液细胞分析仪(离心法)的术语和定义、组成、要求、试验方法、标志、标签、使用说明书、包装、运输和贮存。本标准适用于对人类血液中细胞-成分进行定量分析的干式血液细胞分析仪(离心法)。
12、YY/T 1454—2016《自我检测用体外诊断医疗器械基本要求》
本标准规定了自我检测用体外诊断医疗器械的基本要求,以满足自测用体外诊断医疗器械的安全性以及制造商预期的用途。本标准不适用于自测用体外诊断医疗器械的医学特性。
13、YY/T 1455—2016《应用参考测量程序对酶催化活性浓度赋值及其不确定度评定指南》
本标准规定了应用参考测量程序对酶催化活性浓度赋值及其不确定度评定的方法。本标准适用于体外诊断系统的参考测量实验室应用参考测量程序对酶催化活性浓度赋值及其不确定度评定工作。
14、YY/T 1456—2016《铁蛋白定量检测试剂(盒)》
本标准规定了铁蛋白定量检测试剂(盒)的要求、试验方法及标志、标签、使用说明书、包装、运输和贮存等内容。本标准适用于以抗原-抗体反应为基本原理的定量检测血液样本或尿液样本中铁蛋白的试剂(盒),包含定量标记免疫方法[如酶联免疫吸附法(ELISA)、时间分辨荧光免疫分析法、(电)化学发光法等]和免疫比浊法(如免疫透射比浊法、胶乳增强免疫比浊法等)。本标准不适用于对铁蛋白校准品和质控品的评价。
15、YY/T 1458—2016《抗甲状腺过氧化物酶抗体定量检测试剂(盒)(化学发光免疫分析法)》
本标准规定了抗甲状腺过氧化物酶抗体定量检测试剂(盒)(化学发光免疫分析法)要求、试验方法、标识、标签、使用说明书、包装、运输和贮存。本标准适用于以化学发光免疫分析法为原理定量测定人抗甲状腺过氧化物酶抗体试剂(盒)。
16、YY/T 1459—2016《人类基因原位杂交检测试剂盒》
本标准规定了人类基因原位杂交检测试剂盒标准的要求、检验方法、使用说明、标志、标签以及包装、运输、贮存。本标准适用于进行人类基因扩增、重组、缺失等检测的原位杂交检测试剂盒,一般包括荧光原位杂交试剂盒和显色原位杂交试剂盒。本标准不适用于:进行非人类基因(如病毒、细菌等)检测的原位杂交检测试剂盒;与其他检测方法(如PCR、流式细胞术等)结合使用杂交检测试剂盒。
17、YY/T 1460—2016《血液流变仪》
本标准规定了血液流变仪的术语和定义、分类、要求、试验方法、标志、标签和使用说明书、包装、运输及贮存等。
18、YY/T 1461—2016《缺血修饰白蛋白测定试剂(盒)》
本标准规定了缺血修饰白蛋白测定试剂(盒)(白蛋白-钴结合法)的术语、要求、试验方法、标签、使用说明书、包装、运输和贮存等。本标准适用于使用白蛋白-钴结合法对人血清中缺血修饰白蛋白(IMA)进行定量检测的试剂(盒),基于分光光度法原理,包括手工试剂和在半自动、全自动生化分析仪上使用的试剂。
19、YY/T 1462—2016《甲型H1N1流感病毒RNA检测试剂盒(荧光PCR法)》
本标准规定了甲型H1N1流感病毒RNA检测试剂盒的术语和定义、要求、试验方法、标识、标签、使用说明书、包装、运输和贮存。本标准适用于以荧光PCR法为原理,定性检测人鼻、咽拭子或其他呼吸道分泌物样本中甲型H1N1流感病毒RNA的诊断试剂盒。
20、YY/T 0589—2016《电解质分析仪》
本标准适用于以离子选择电极为传感器的电解质分析仪,该仪器适用于人体临床电解质项目检测。生化分析仪上的电解质模块也可参照该标准。本标准规定了电解质分析仪的分类、基本参数、要求、试验方法、标志、标签、使用说明书、包装、运输和贮存等内容。本标准代替YY/T 0589—2005《电解质分析仪》。
21、YY/T 1422—2016《血清妊娠相关血浆蛋白A检测试剂(盒)(定量标记免疫分析法)》
本标准规定了血清妊娠相关血浆蛋白A检测试剂(盒)(定量标记免疫分析法)的要求、试验方法、标识、标签、使用说明书、包装、运输和贮存要求等。本标准适用于进行血清妊娠相关血浆蛋白A定量检测试剂(盒)(定量标记免疫分析法)。本标准不适用于各类胶体金标记试纸、用125I等放射性同位素标记的各类放射免疫或免疫放射试剂盒。
22、YY/T 1482—2016《单纯疱疹病毒IgG抗体检测试剂(盒)》
本标准规定了单纯疱疹病毒IgG抗体检测试剂(盒)的技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。本标准适用于定性检测人体血清/血浆中单纯疱疹病毒1型IgG抗体检测试剂(盒)、单纯疱疹病毒2型IgG抗体检测试剂(盒)、单纯疱疹病毒1+2型IgG抗体检测试剂(盒),方法学为酶联免疫法、化学发光法、免疫荧光法、免疫印迹法等。
23、YY/T 1483—2016《单纯疱疹病毒IgM抗体检测试剂(盒)》
本标准规定了单纯疱疹病毒IgM抗体检测试剂(盒)的技术要求、试验方法、标识、标签和说明书、包装、运输和贮存等。本标准适用于定性检测人体血清/血浆中单纯疱疹病毒1+2型IgM抗体检测试剂(盒),方法学为酶联免疫法、化学发光法、免疫荧光法、免疫印迹法。
附件:
![]() 2.SACTC136归口行业标准列表(2016年12月).doc
2.SACTC136归口行业标准列表(2016年12月).doc
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设