热门搜索:分会介绍 | 会员名单 | 行业资讯

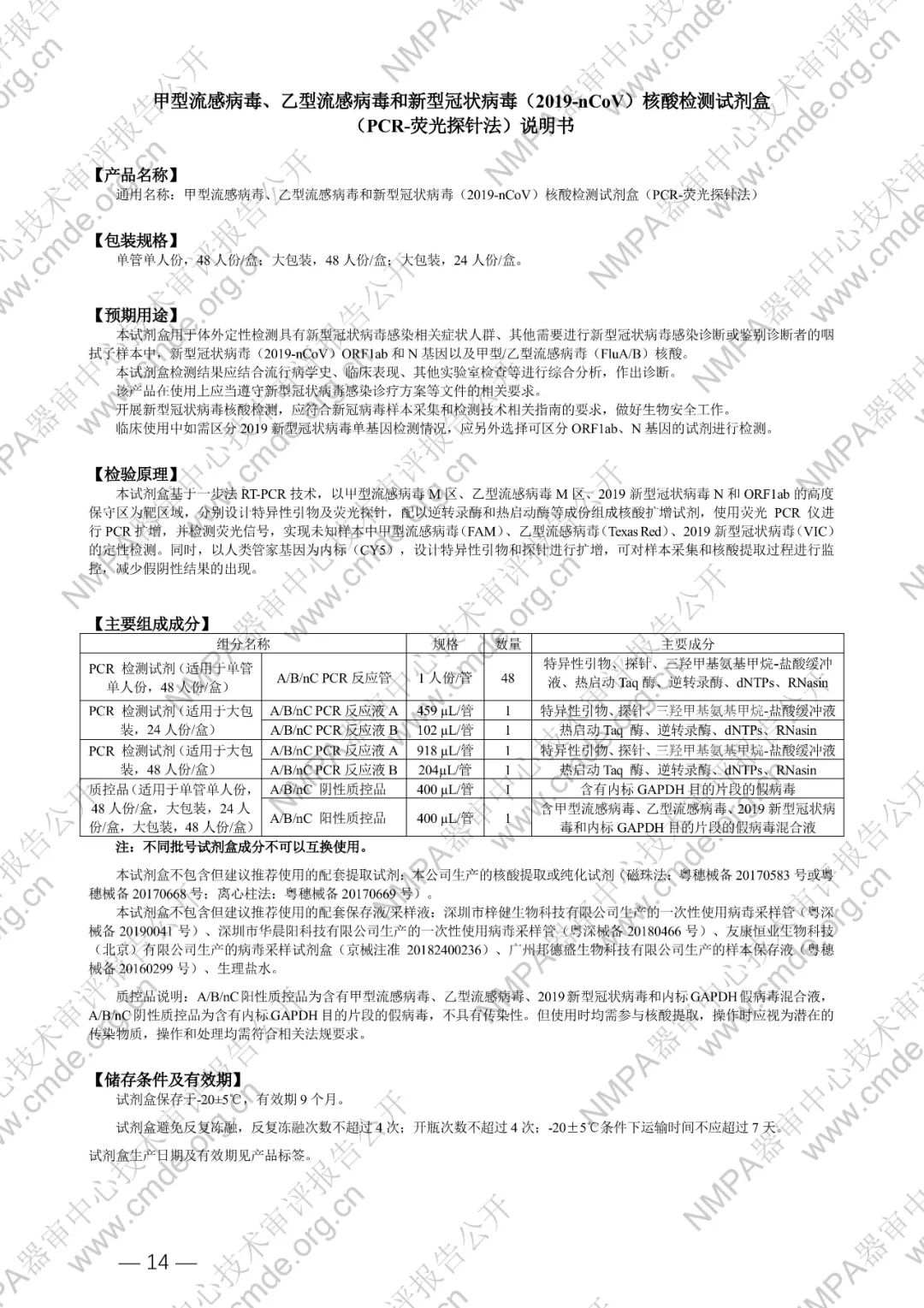
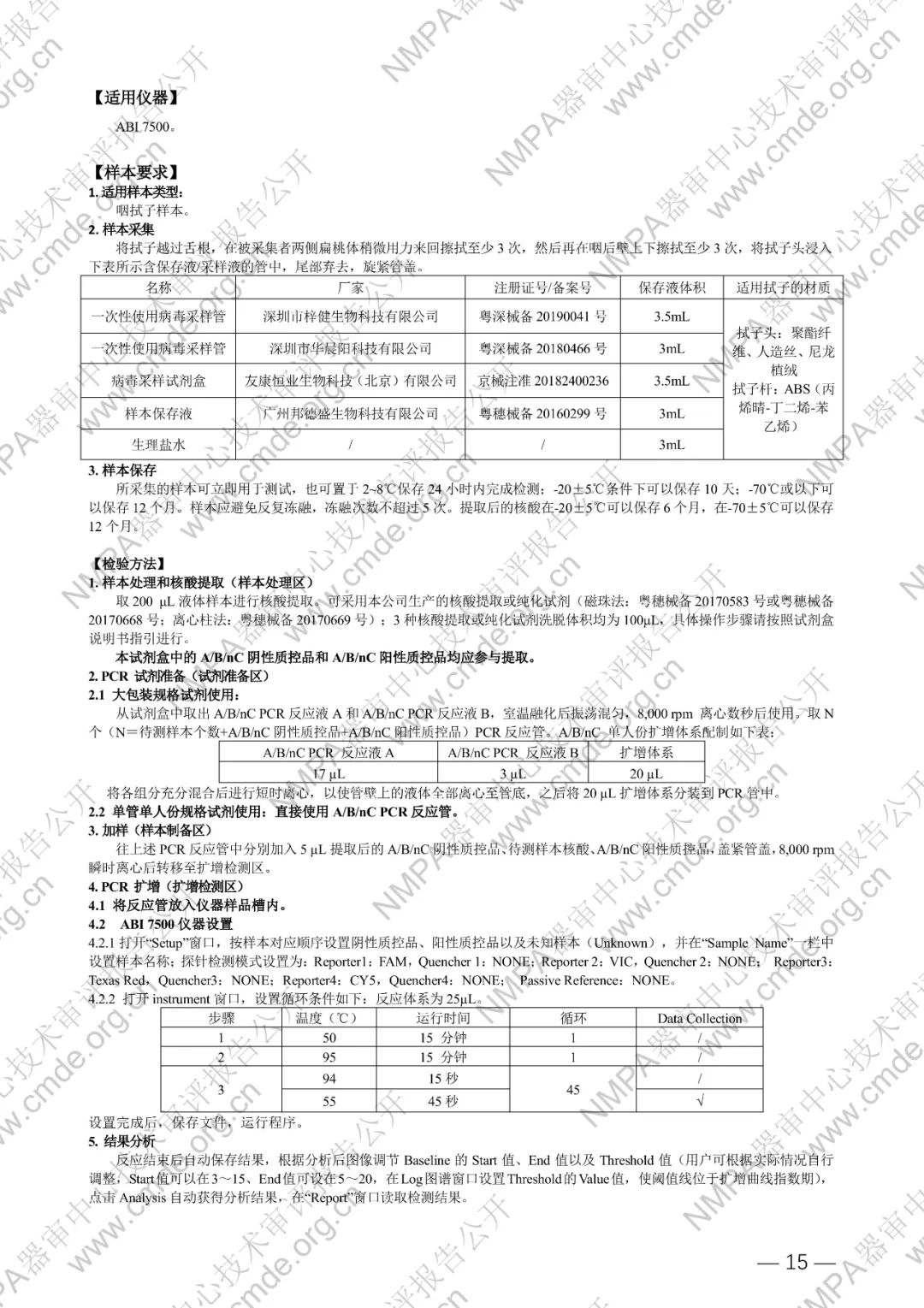
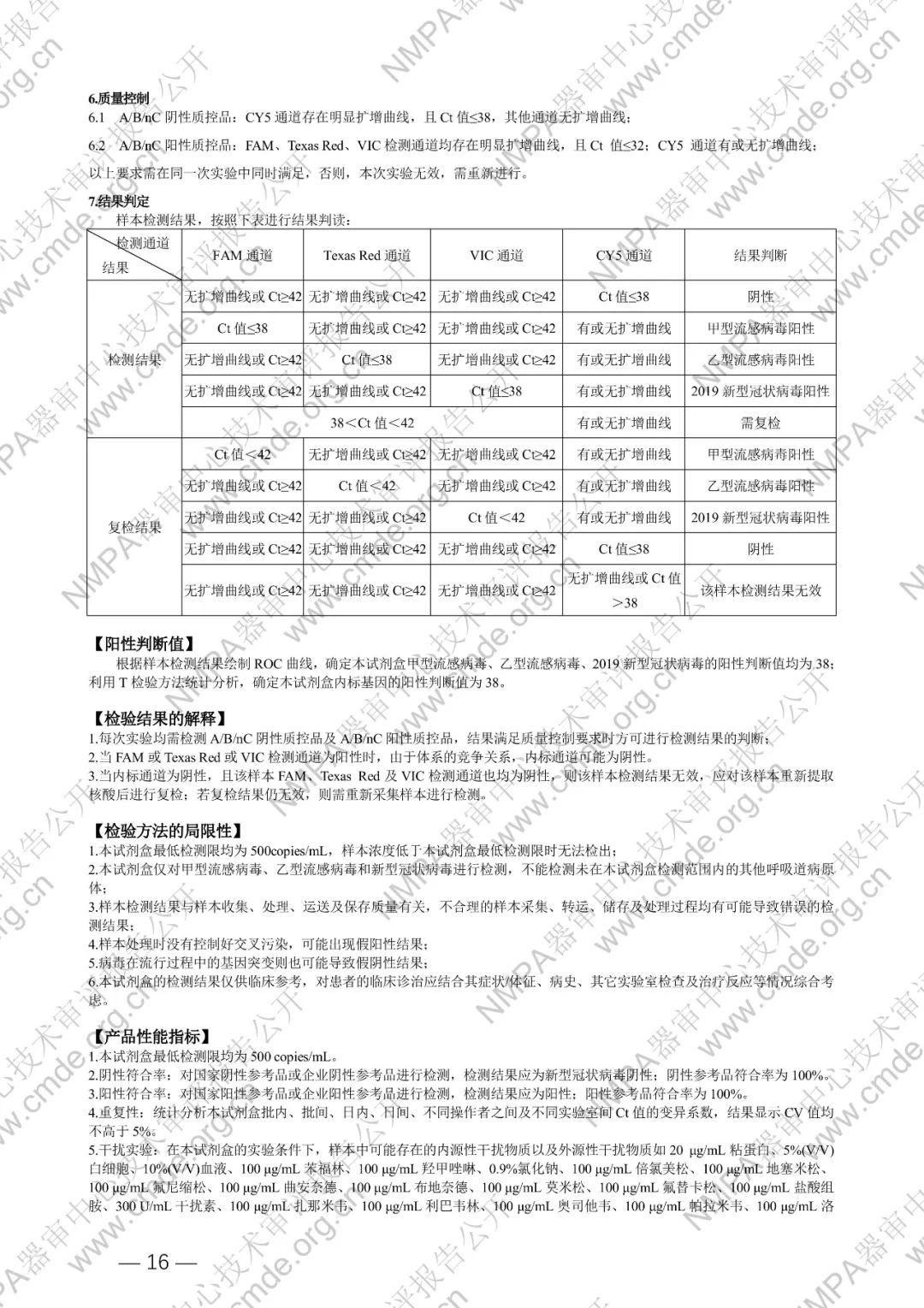
国家药品监督管理局医疗器械技术审评中心于2024年5月8日公开《甲型流感病毒、乙型流感病毒和新型冠状病毒(2019-nCoV)核酸检测试剂盒(PCR-荧光探针法)》产品注册技术审评报告。申请人:广州达安基因股份有限公司。
本试剂盒用于体外定性检测具有新型冠状病毒感染相关症状人群、其他需要进行新型冠状病毒感染诊断或鉴别诊断者的咽拭子样本中,新型冠状病毒(2019-nCoV)ORF1ab 和 N 基因以及甲型/乙型流感病毒(FluA/B)核酸。
本试剂盒基于一步法 RT-PCR 技术,以甲型流感病毒 M 区、乙型流感病毒 M 区、2019 新型冠状病毒 N 和 ORF1ab 的高度保守区为靶区域,分别设计特异性引物及荧光探针,配以逆转录酶和热启动酶等成份组成核酸扩增试剂,使用荧光 PCR 仪进行 PCR 扩增,并检测荧光信号,实现未知样本中甲型流感病毒(FAM)、乙型流感病毒(Texas Red)、2019 新型冠状病毒(VIC)的定性检测。同时,以人类管家基因为内标(CY5),设计特异性引物和探针进行扩增,可对样本采集和核酸提取过程进行监控,减少假阴性结果的出现。
















来源:NMPA
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设