5月3日,中国科学院上海免疫与感染研究所张晓明研究员与复旦大学附属中山医院高强教授、樊嘉院士及浙江大学郭国骥教授合作在Science上发表了题为“A blueprint for tumor-infiltrating B cells across human cancers”的研究论文,揭示了肿瘤浸润B细胞的两种应答模式及其对抗肿瘤免疫的影响,为发展新型免疫治疗策略提供了重要基础。

马家强、吴英成、马立枫、杨旭鹏和张天成为论文共同第一作者,中国科学院上海免疫与感染研究所(原中国科学院上海巴斯德研究所)张晓明研究员、复旦大学附属中山医院高强教授和樊嘉院士、浙江大学郭国骥教授为本文通讯作者。
目前的肿瘤免疫治疗聚焦于重建T细胞和NK细胞的功能,但只对一小部分患者有效,亟需发展新的免疫治疗策略。B细胞作为抗体应答的效应细胞,通过生发中心(Germinal center,GC)或滤泡外(Extra-follicular,EF)途径分化为浆细胞。B细胞也是肿瘤浸润淋巴细胞的一个重要组分,但B细胞发挥抗肿瘤或促肿瘤作用仍存在广泛争议。近年来泛癌尺度的肿瘤微环境(Tumor microenvironment, TME)中免疫细胞的相关研究, 为系统性探究B细胞异质性及功能提供了新的思路。
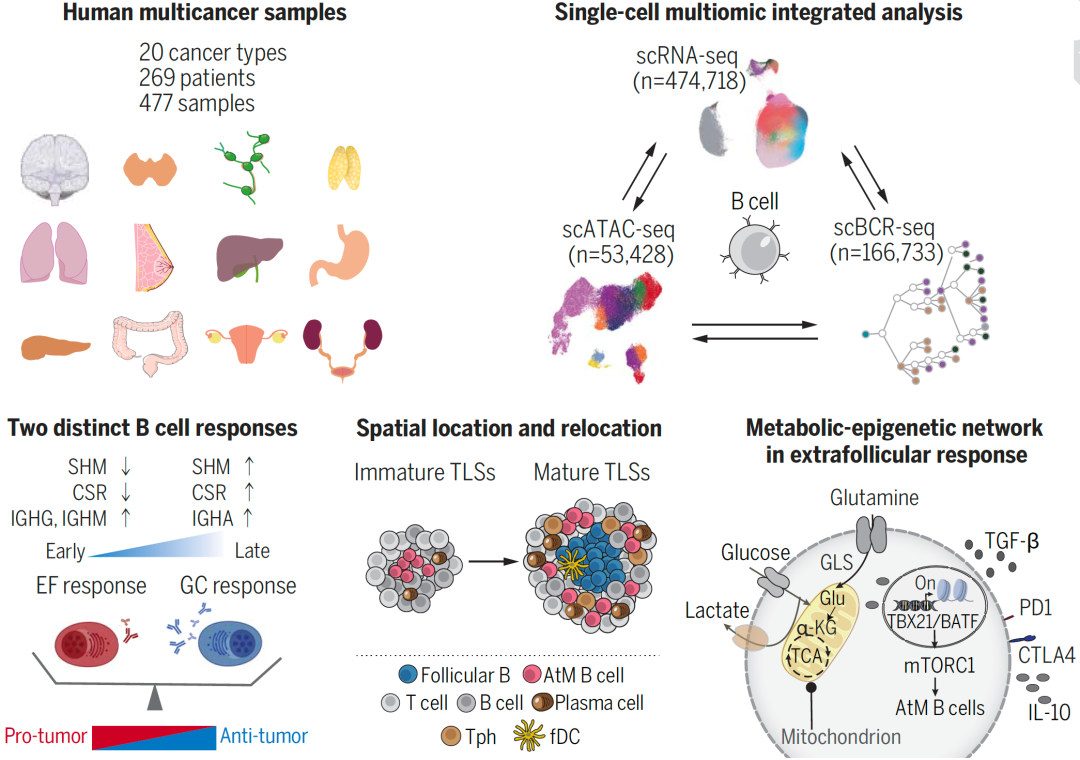
图. 单细胞多组学解析肿瘤滤泡外B细胞应答的分子特征及调控机制
在这项研究中,研究者通过整合自测数据(69.24%)和公共数据共20个癌种、269例患者共计477例样本的B细胞单细胞转录组,利用聚类分析发现B细胞可分为15大群,包括IFIT3+炎性B细胞、DUSP4+非典型记忆(Atypical memory, AtM)B细胞、生发中心(GC)B细胞和浆细胞等。对浆细胞进一步聚类可分为10个不同的亚群。重要的是,肿瘤浸润浆细胞的分化可分为GC和EF应答两种不同途径,并且具有明显的癌种偏好性。例如,肝癌主要由EF应答驱动,而肠癌则主要由GC应答驱动。研究者还深入比较了这两种来源的浆细胞在转录组、BCR免疫组库和表观遗传调控等方面的差异;通过运用不同的单细胞轨迹算法、流式细胞术和多重免疫荧光标记等技术,分别表征了EF来源浆细胞的早期应答特征和GC来源浆细胞的晚期应答特征。
研究者进一步聚焦研究了EF来源浆细胞的前体细胞——DUSP4+AtM B细胞,描绘了其在肿瘤中特殊的表型、功能、空间定位和调控机制。研究发现,AtM B细胞表现为耗竭和旁观活化的表型,分泌识别自身抗原的抗体,并且其分化途径独立于GC。研究还揭示了AtM B细胞定位于不成熟TLSs的中心位置,而在成熟TLSs中则定位于外周。进一步发现,PD1HiCD4+ 外周辅助T细胞(Tph)细胞与AtM B细胞在空间上存在共定位,并通过IL21-IL21R轴诱导AtM B细胞的分化。
最后,研究者通过单细胞代谢通路分析、非靶向质谱和体外诱导分化等技术,发现谷氨酰胺衍生的代谢物α-酮戊二酸会增加B细胞的H3K27三甲基化,激活哺乳动物雷帕霉素靶复合物1(mTORC1)信号传导,继而促进AtM B细胞相关转录因子Tbet和BATF的表达,诱导AtM B细胞的分化。研究者还发现,AtM B 细胞获得了抑制T细胞的免疫调节功能,促进了免疫抑制TME的形成,并且在多个癌种中AtM B 细胞与不良预后和免疫治疗抵抗相关。
综上,这项工作创新性地描绘了多癌种B细胞的转录组、BCR免疫组库和表观组的单细胞多组学图谱,揭示了肿瘤浸润B细胞存在抗肿瘤与促肿瘤2种截然不同的应答模式,并深入分析了肿瘤浸润AtM B细胞的分子特征、分化路径、空间定位、癌种特异性及临床相关性,提出靶向抑制滤泡外B细胞应答、促进抗肿瘤免疫的免疫治疗新方向。
