

4月8日,巴西卫生监督管理局ANVISA(Agência Nacional de Vigilância Sanitária)公布290/2024指令,指令明确将会优化医疗器械的注册审批流程。
通过此项措施,ANVISA将加快已在其他国家获得产品证书的医疗器械在巴西的审批过程。
指令规定,从今年6月3日起,澳大利亚、加拿大、美国、日本这四个国家监管机构批准的医疗器械将有可能缩短其在巴西ANVISA的审批周期。
对此,医疗器械制造商需要提交相应的文件,证明申请注册产品和已在上述国家获批产品的预期用途、产品参数、描述等信息是一致的。
Pure Global 普瑞纯证 旗下巴西自营公司 PURE LATAM BRAZIL COMERCIO DE PRODUTOS HOSPITALARES LTDA 为中国医疗器械制造商提供巴西ANVISA注册服务。
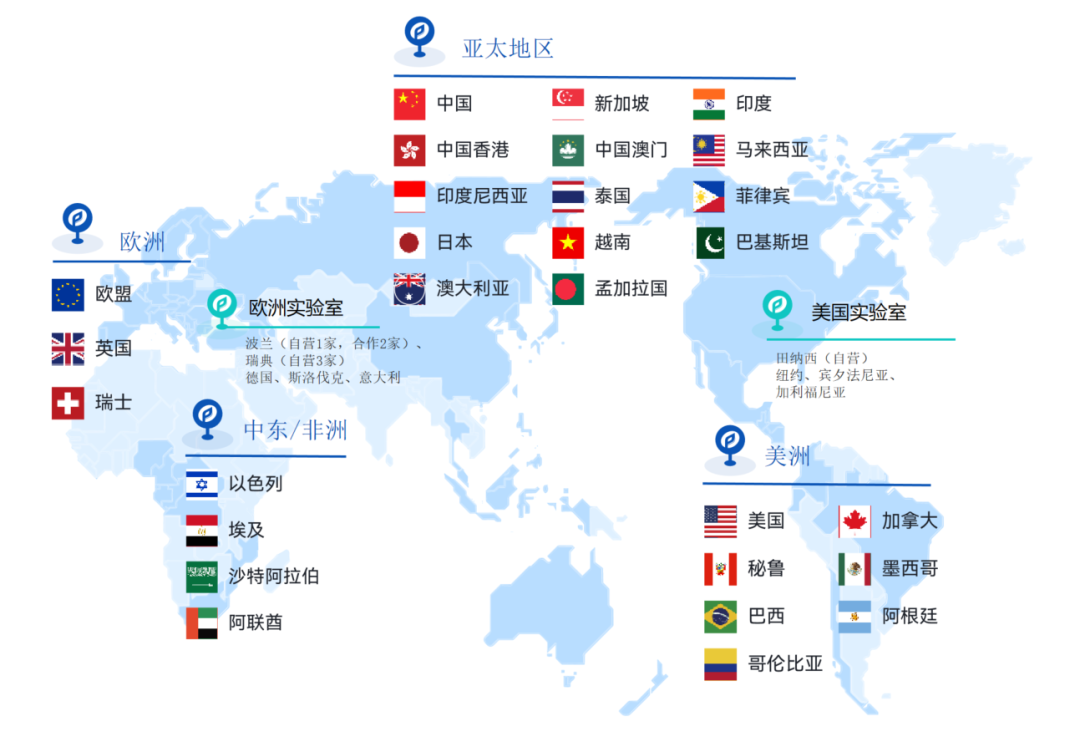
2024年至今,Pure Global 普瑞纯证和全球注册各地分公司已协助中国制造商成功获得包括巴西、美国、加拿大、新加坡、沙特阿拉伯等11个国家或地区的近百张注册证书。


Pure Global 普瑞纯证 是全球为数不多的通过BSI ISO 13485:2016质量体系认证的医疗器械技术服务公司,依托AI和大数据技术,自研GRIP全球法规智能平台,覆盖全球70+个国家/地区的数据库,一站式解决企业出海难题。
我们拥有全球法规专家团队,支持全球27个国家/地区注册准入服务并在相应国家/地区设立了当地代表、拥有全球数百个合作临床实验室和全球临床专家团队。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设