
作者:周杰 教授
大连市友谊医院 检验科主任
肝癌是世界上最常见且恶性程度最高的肿瘤之一,每年新增病例约854,000人,是全球第六大最常见癌症;每年死亡810,000人,是全球第四大癌症相关死亡原因。肝癌发病率随着年龄的增长而增加,在70岁时达到峰值,在中国和非洲黑人人群中,发病率到达峰值的平均年龄更低,针对高危人群的肝癌早筛,对提高临床治愈率和生存时间具有重要意义1-2。
一、肝癌流行病学及血清标志物应用
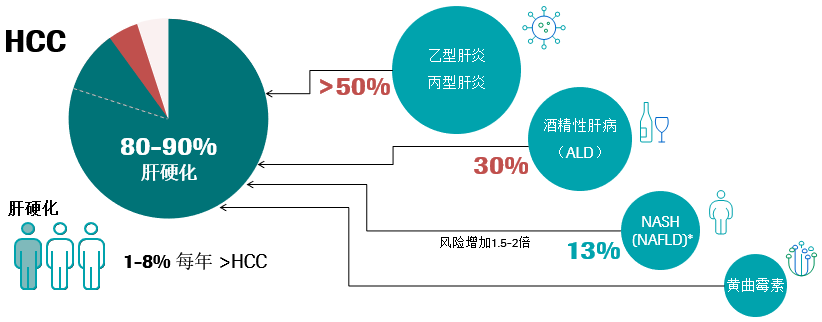
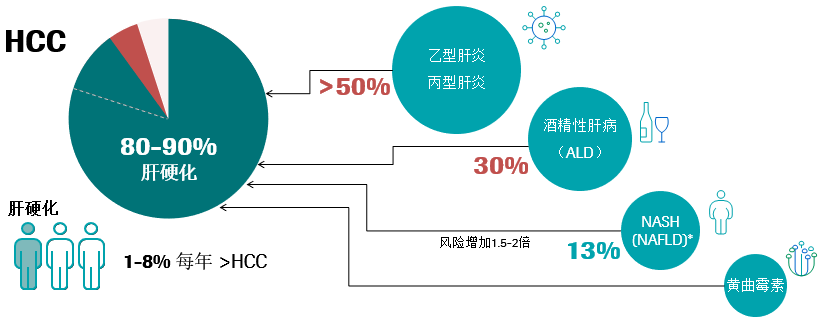
肝细胞癌(HCC)是肝脏的原发性恶性肿瘤,是原发性肝癌的最常见形式(90%),占所有癌症的7%。95%以上的HCC在慢性肝病的背景下发展,80%-90%的HCC来自潜在的肝硬化,三分之一的肝硬化患者会以每年1–8%的速度发展成HCC。慢性肝损伤和肝脏炎症会导致肝硬化的形成,其中乙型肝炎和丙型肝炎占肝硬化50%以上,酒精性肝病(ALD)占肝硬化的30%以上,肥胖和糖尿病患者的HCC风险比一般人群高1.5–2倍,它们通过导致肝脏炎性病变、瘢痕组织的形成,进一步发展出现肝纤维化和肝硬化等情况1-5。
(一)HCC是一种高死亡率的疾病
慢性肝炎是一种长期发展的疾病,肝脏会在数年内逐渐受损。5%-20%的HBV感染和80%的HCV感染会成为慢性病,如果肝炎成为慢性病,肝脏中损害与再生的平衡就会被打破,并可能导致形成过多的疤痕组织,即纤维化。从长期来看(超过20-30年),肝脏纤维化的加剧将导致肝硬化,其中70%-90%是HBV和HCV的感染者,在肝硬化阶段对肝脏造成的损害往往是不可逆的或难以治疗的,经常导致因肝衰竭或HCC而死亡。在没有终末期肝病背景下,HBV感染可促使HCC的发展。10%-30%HBV驱动的HCC病例发生在没有肝硬化的情况下,甚至可以在没有炎症的情况下发展。可见HBV可独立于炎症而促进HCC的发展,HBV基因组可以整合到宿主的基因组中,诱发染色体改变和癌基因的插入突变。因此防止发展为肝硬化、终末期肝病、HCC和死亡是治疗和干预的终极目标6-8。
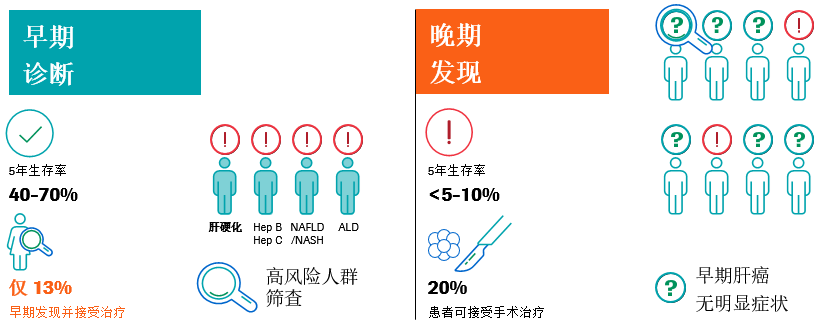
HCC早期多“无症状 ”,所以对高危人群进行监测,以便于早发现、早诊断和早治疗。如果在症状出现后被诊断,其中大约只有20%的患者在诊断时符合切除标准,5年生存率小于5%-10%。只有约13%的患者被早期诊断和早期治疗,早期诊断可将5年生存率提高到40%-70%9-11。
(二)HCC的监测
需要区分的是筛查是对人群进行测试来识别哪些人需要进一步的测试和治疗,并从中获益;而监测是在高危人群中使用筛查/诊断测试来对疾病的发生进行定期诊断测试,以达到与筛查相同的目标12。针对HCC的监测,目的在于启动潜在的治疗性干预措施,降低总体发病率、死亡率和医疗系统的财务负担。监测间隔是介于肿瘤加倍时间和筛查费用之间的平衡,HCC翻倍时间1-19个月不等,中位数为4-6个月。大多数研究方案建议每6个月进行一次筛查,HCC监测的关键是精准定位高风险人群:40以上的高龄男性和50岁以上的女性,有HCC家族史和潜在的肝硬化患者是其高危人群9,13-15。
HCC的监测经证实对生存率有积极影响,可以有效降低患者死亡率。该研究纳入了18816名年龄在35-59岁之间、患有HBV感染或有慢性肝炎病史的患者。参与者被随机分配到监测组(9373)或对照组(9443)。对照组没有接受监测,继续使用卫生保健设施。监测组每 6个月进行一次 AFP 测试和超声检查,对照组中没有患者存活超过5年,与对照组相比,监测组患者有明显的生存优势。研究结果表明,每半年筛查一次可将HCC死亡率降低37%16。

针对HCC的监测,超声是指南推荐的主要监测方法,但是仪器性能差异以及医护人员的解读能力、肝纤维化对超声的影响、肥胖对检测的影响仍制约着HCC早期检测的灵敏度和特异度17。荟萃分析显示超声诊断的HCC灵敏度差异极大18,当前以AFP、AFP-L3、PIVKA-II和GP73为代表的肝癌四项生物标志物,正成为肝癌早期发现和早期诊断的重要指标19-21。

(三)什么是PIVKA-II?
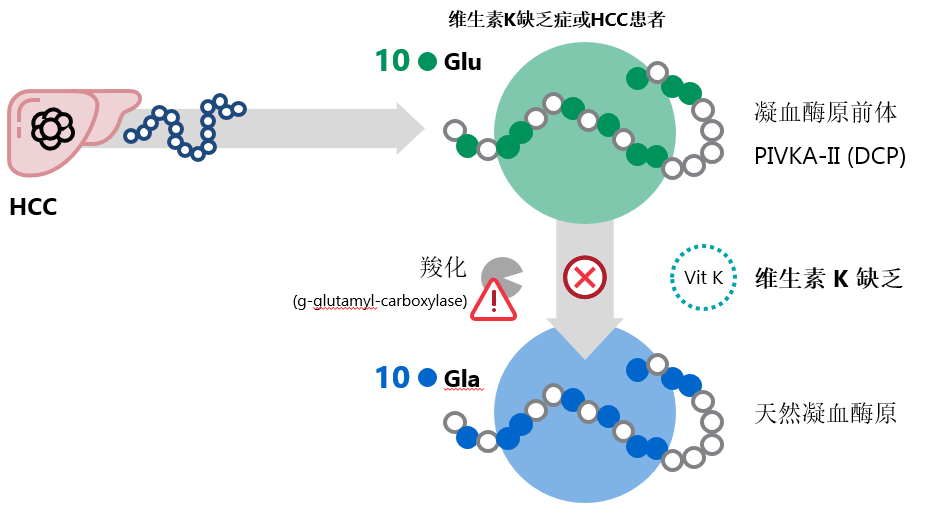
PIVKA-II是指由于维生素K缺乏或拮抗剂-II诱导的蛋白质(又称去甲羟基凝血酶[DCP]),凝血蛋白凝血酶的前体和异常形式,与肝癌的发生、发展、浸润和转移密切相关。当一个或多个Gla残基没有维生素K或存在抑制维生素K依赖性羧化酶活性的拮抗剂的情况下没有完全羧化为γ-羧基谷氨酸时,就会产生PIVKA-II并丧失凝血活性。在HCC中,PIVKA-II的产生是由于获得性的翻译后羧化缺陷存在22,23。
二、PIVKA-II应用的相关研究
肝细胞癌(HCC)是肝脏的原发性恶性肿瘤,是原发性肝癌的最常见形式(90%),占所有癌症的7%。95%以上的HCC在慢性肝病的背景下发展,80%-90%的HCC来自潜在的肝硬化,三分之一的肝硬化患者会以每年1–8%的速度发展成HCC。慢性肝损伤和肝脏炎症会导致肝硬化的形成,其中乙型肝炎和丙型肝炎占肝硬化50%以上,酒精性肝病(ALD)占肝硬化的30%以上,肥胖和糖尿病患者的HCC风险比一般人群高1.5–2倍,它们通过导致肝脏炎性病变、瘢痕组织的形成,进一步发展出现肝纤维化和肝硬化等情况1-5。
(一)PIVKA-II 在临床上可用于HCC的辅助诊断24-27
一项基于中国人群阳性判断值的临床性能研究共纳入448例患者,分为HCC病例和非HCC病例,真阳性患者157例,真阴性患者239例。当Elecsys PIVKA-II阳性判断值为21.29ng/ml时,临床灵敏度:84.86%(95%CI:79.00%,89.32%),临床特异性:90.87%(95%CI:86.78%,93.79%)。
(二)相比于AFP,PIVKA-II有更高的灵敏度30,31
研究者采用BCLC分期方案对部分入组HCC病例组的受试者进行分期,分为HCC早期组(BCLC 0+A)和HCC中晚期组(BCLC B+C+D)。其中HCC早期组灵敏度高达71.05%,中晚期组达到95.89%,这对于PIVKA-II监测HCC有重大意义。进一步比较PIVKA-II与AFP的临床性能,发现128例AFP阴性人群中有103例PIVKA-II检测为阳性,表明PIVKA-II比AFP有更多的检出,在AFP阴性人群中仍可以识别出一部分HCC阳性人群,说明PIVKA-II比AFP有更高的灵敏度。
(三)PIVKA-II和肿瘤的大小、患者的预后有直接相关性29
基于BCLC分期的对照组和HCC组中PIVKA-II分布范围如下,可以发现PIVKA-II浓度值随着HCC疾病进展而增加。
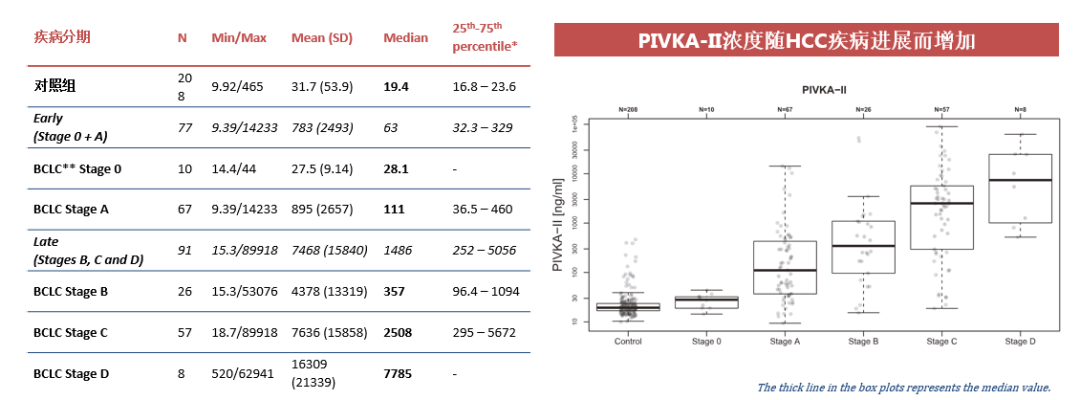
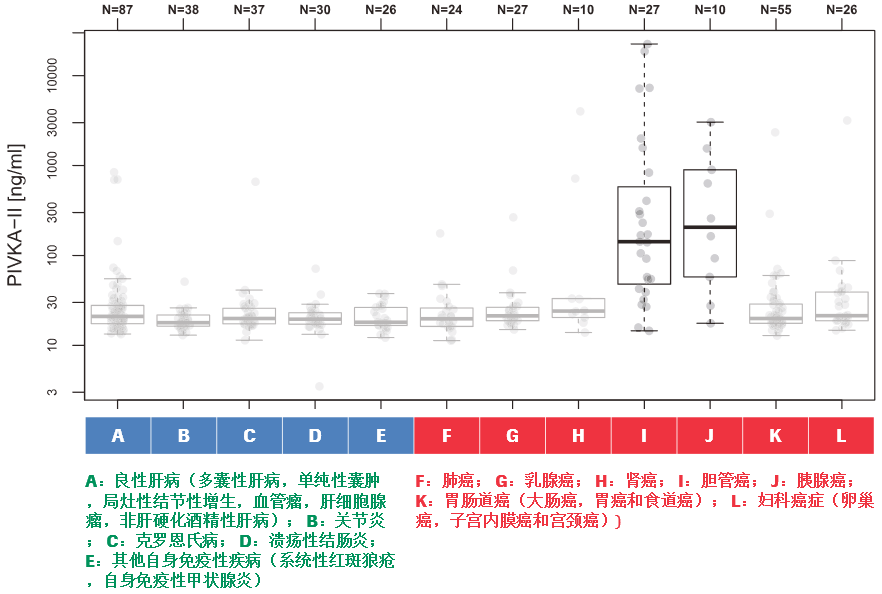
(四)在区分肝硬化和早期肝癌,PIVKA-II 表现出高敏感性和特异性28
研究者同时还发现不同病因导致的HCC,PIVKA-II检测结果值数据存在显著性差异性。对照组无肝癌,HCC组有肝癌,通过PIVKA-II的浓度可以清晰区分对照组和HCC患者。在患有良性肝病、免疫疾病或非HCC恶性肿瘤的患者中,没有观察到升高的PIVKA-II水平(>1000 ng/mL),通过PIVKA-II测量得到结果升高的患者,主要在肝癌中,而在8例胆管癌和胰腺癌患者,5例有胆汁淤积性疾病患者中未观察到PIVKA-II水平升高。
三、GAAD 在肝癌患者早期诊断的价值
当前肝细胞癌相关的标志物有血清生物标志物、蛋白质生物标志物、MicroRNA生物标志物、免疫生物标志物,种类非常多,单一血清标志物诊断不足,新型标志物尚不成熟且检测成本昂贵。理想的肝癌标志物需要有较高的特异性,能够将肝癌与肝硬化、肝炎、肝脏再生结节等疾病区分开来;同时还需较高的敏感性,能够在肝癌早期即提示诊断,同时应具有易检测、可重复、可经非侵入性操作测定等特点。
在联合检测的基础上,搭载数字化算法GAAD,可进一步提升检测性能和效益,为患者全病程管理提供有力支持。在截断值为2.57时, GAAD在检测早期 HCC 方面显示出高特异性和良好的敏感性,GAAD 在早期和全阶段监HCC方面优于 AFP。

作为目前平均成本最低的HCC患者筛查策略,GAAD联合超声对于HCC患者的检出率最高,并且早期HCC病例比例最高,已成为早期HCC诊断最具成本效益的策略。
四、总结
肝癌是全球最常见且恶性程度最高的肿瘤之一,肝细胞癌是肝癌的最常见形式。当前以AFP和PIVKA-II为代表的肝癌生物标志物,正成为肝癌早期发现和早期诊断的重要指标。PIVKA-II作为新兴的肝癌标志物之一,在临床上可用于HCC的辅助诊断,联合AFP提高肝细胞癌的早期诊断。
参考文献:
1. Fitzmaurice C et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level Results From the Global Burden of Disease Study 2015. JAMA Oncol. 2017;3(12):1683-1691.
2. Llovet JM et al. Hepatocellular carcinoma. Nat Rev Dis Prim 2016;14:2:16018.
3. GBD 2015 Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016;388 :1459-1544.
4.El-Seraq HB. Epidemiology of Viral Hepatitis and Hepatocellular Carcinoma. Gastroenterology 2012;142(6):1264-1273.
5. Charrez, Bérénice et al. Hepatocellular carcinoma and non-alcoholic steatohepatitis: The state of play. World Journal of Gastroenterology 2012;22:2494-502.
6. Bartosch B. Hepatitis B and C Viruses and Hepatocellular Carcinoma. Viruses 2010;2:1504-1509.
7. Hiotis SP et al. Hepatitis B vs. hepatitis C infection on viral hepatitis-associated hepatocellular carcinoma. BMC Gastroenterology 2012;12:64.
8. Ringehan M et al. Viral hepatitis and liver cancer. Phil. Trans. R. Soc. B 2017;372: 20160274.
9. Bialecki ES, Di Bisceglie AM. Diagnosis of hepatocellular carcinoma. HPB 2005; 7: 26–34.
10. El-Serag HB et al. Surveillance for hepatocellular carcinoma: in whom and how? Ther Adv Gastroenterol 2011; 4: 5–10.
11. El-Serag HB et al. Treatment and outcomes of treating of hepatocellular carcinoma among Medicare recipients in the United States: a population-based study. J Hepatol 2006; 44: 158–66.
12. Meissner HI, Smith RA, Rimer BK, et al. Promoting cancer screening: Learning from experience. Cancer. 2004;101(5 Suppl):1107–17.
13. Sarasin F et al. Cost-effectiveness of screening for detection of small hepatocellular carcinoma in western patients with Child-Pugh class A cirrhosis. Am J Med 1996;101:422–434.
14. Sherman M et al. Surveillance for hepatocellular carcinoma. Best Pract Res Clin Gastroenterol 2014;28:783–793.
15. Díaz-González Á, Forner A. Surveillance for hepatocellular carcinoma. Best Pract Res Clin Gastroenterol 2016;30:1001–1010.
16. Zhang BH et al. Randomized controlled trial of screening for hepatocellular carcinoma. J Cancer Res Clin Oncol 2004;130: 417-22.
17. Pazgan-Simon, M. et al. Diagnostic Challenges in Primary Hepatocellular Carcinoma: Case Reports and Review of the Literature. Case Reports in Oncological Medicine 2015, Article ID 878763.
18. Tzartzeva K et al. Surveillance Imaging and Alpha Fetoprotein for Early Detection of Hepatocellular Carcinoma in Patients With Cirrhosis: A Meta-analysis. Gastroenterology 2018;154:1706–1718.
19. Tsuchiya N et al. Biomarkers for the early diagnosis of hepatocellular carcinoma. Cancer Biomarkers 2007: 3, 79-87.
20. Yoshida K. New Biomarkers for Early Detection of Hepatocellular Carcinoma. EBioMedicine 2 (2015) 370–371.
21. Juárez-Hernández E et al. Biomarkers in hepatocellular carcinoma: an overview. Expert Review OF Gastroenterology & Hepatology 2017.
22. Liebmann, H.A. et al. (1984). Des-gamma-carboxy (abnormal) prothrombin as a serum marker of primary hepatocellular carcinoma. N Eng J Med 310, 1427-1431.
23. Ono, M. et al. (1990). Measurement of immunoreactive prothrombin precursor and vitamin-K-dependent gamma-carboxylation in human hepatocellular carcinoma tissues: Decreased carboxylation of prothrombin precursor as a cause of des-gamma-carboxy prothrombin synthesis. Tumour Biol 11, 319-326.
24. Lamerz R et al. Use of serum PIVKA-II (DCP) determination for differentiation between benign and malignant liver diseases. Anticancer Research 1999: 19, 2489-2494
25. Nakamura S et al. Sensitivity and Specificity of Des-Gamma-Carboxy Prothrombin for Diagnosis of Patients with Hepatocellular Carcinomas Varies According to Tumor Size. Am J Gastroenterol 2006: 101, 2038-2043
26. Wang CS et al. Usefulness of serum des-γ-carboxy prothrombin in detection of hepatocellular carcinoma. World J Gastroenterol 2005: 11, 6115-6119
27. Marrero JA et al. Des‐gamma carboxyprothrombin can differentiate hepatocellular carcinoma from nonmalignant chronic liver disease in american patients. Hepatology 2003: 37, 1114-1121
28. Volk ML, et al. Risk factors for hepatocellular carcinoma may impair the performance of biomarkers: a comparison of AFP, DCP, and AFP-L3. Cancer Biomark. 2007;3:79–87
29. Durazoo FA et al. Des-gamma-carboxyprothrombin, alpha-fetoprotein and AFP-L3 in patients with chronic hepatitis, cirrhosis and hepatocellular carcinoma. J Gastroenterol Hepatol 2008: 23,1541-1548
30. Lok A. et al. HALT-C Trial Group. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma. Gastroenterology 2010; 138: 493-502.
31. Ertle JM et al. A combination of α-fetoprotein and des-γ-carboxy prothrombin is superior in detection of hepatocellular carcinoma. Digestion 2013;87:121–131
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设