
结直肠癌是人类最常见的恶性肿瘤之一,全球发病率居恶性肿瘤第3位,死亡率居第5位。在我国,结直肠癌发病率亦呈现逐年上升趋势。根据 2024年国家癌症中心数据显示,2020 年中国结直肠癌新发病例56万,死亡病例 29万。结直肠癌的早期筛查及预防可以降低发病率、提高治愈率,相关分子标志物的检测是结直肠癌筛查的有效补充,同时对个体化方案的判定、预后判断及疗效预测等方面起到重要作用。
◆检验方法
目前,分子标志物的检测方法包括免疫组织化学(immunohistochemistry,IHC)、荧光原位杂交技术(fluorescence in situ hybridization,FISH)和基因测序等。不同类型的标本和变异需要选择不同的检测方法。其中,IHC检测是指用标记的特异性抗体在组织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、定位、定量测定的一项免疫检测方法。IHC检测是肿瘤诊疗中的重要工具,对判定肿瘤来源、类型、恶性程度、耐药和预后都提供了重要价值。专家表明:对于结直肠癌患者,推荐对经手术切除或活检的原发灶或转移灶组织标本行相关分子标志物的蛋白表达水平检测,以帮助判定肿瘤来源和类型。
同时,IHC也有一定的局限性,包括:1、常规免疫组化的分析属于定性分析,其判断大多依赖于经验,其分析结果会有差异;2、常规免疫组化受传统染色成像的限制,靶标少于 3 个,无法完整分析组分信息等。2022年1月份卞修武院士发表了重要评论文章,指出传统诊断病理学正向下一代诊断病理学(NGDP)迈进,以病理形态和临床信息为诊断基础,以分子检测与生物信息分析,多组学和跨尺度整合诊断是其主要特征,未来需要激发病理学科对创新活力,整合多组学技术,包括高通量测序、单细胞测序、转录组技术、多重蛋白原位标记测定技术等,共同推动临床医学的进步。
其中,多重荧光免疫组化技术(mIHC)即是卞院士提到的多重蛋白原位标记测定技术中的一种,是由检测单一靶蛋白的标准IHC发展而来的组织检测技术,也是下一代病理(NGP)技术的典型代表。mIHC是基于酪氨信号放大原理,可以在一张FFPE组织切片中进行多种(7-9)标志物染色,通过各标志物的在细胞上的单表达或者共表达,识别不同细胞亚群,结合人工智能软件,将病理医生的局部判读转为客观算法,扩展到全片的定量计算,统计各个组织区域中细胞类型、密度,空间位置关系等信息。
今天小编给大家分享结直肠癌常规免疫组化的标志物,未来也可以通过mIHC对这些标志物进行检测。
◆IHC常规分子标志物检测
1、微卫星不稳定(microsatellite instability,MSI)状态和错配修复(mismatch repair,MMR)蛋白表达
MSI 状态和 MMR蛋白表达是包括结直肠癌在内的泛瘤种免疫检查点抑制剂效果的预测指标。
MMR蛋白的IHC检测,需同时检测4个常见MMR蛋白(MLH1、MSH2、MSH6和PMS2)的表达。其中≥1 种表达缺失,判定为错配修复基因缺陷(dMMR);全部阳性,则判定为错配修复基因完整(pMMR)。
根据微卫星的不同状况可将患者分为3种即:高度微卫星不稳定(MSI-H)、低度微卫星不稳定(MSI-L)和微卫星稳定(microsatellite stable,MSS)。通常采用美国国家癌症研究所推荐的5个微卫星位点(BAT25、BAT26、D5S346、D2S123和D17S250)进行检测,当≥2个微卫星位点显示MSI,即可诊断为MSI-H;1个显示MSI,可诊断为MSI-L;没有任何位点显示MSI,即MSS。一般而言,dMMR相当于MSI-H,pMMR相当于MSI-L或MSS。
MSI-H状态的Ⅱ期和Ⅲ期结直肠癌患者,其预后一般优于MSS患者。MSI-H的Ⅱ期患者,一般预后较好,且不能从氟尿嘧啶(5-FU)类单药化疗中获益,所以建议Ⅱ期患者术后常规进行MSI检测。此外,转移性MSI-H/dMMR患者对于免疫检查点抑制剂疗效较好。Checkmate142研究表明,纳武单抗有效率为31%。而非MSI-H/dMMR患者有效率则显著较低。KEYNOTE-177 研究表明,MSI-H/dMMR 患者姑息一线应用帕博利珠单抗,客观缓解率为43.8%,而标准化疗靶向组显著较低,为33.1%。
MSI/MMR状态对于遗传性结直肠癌的诊断也具有较大的意义,尤其是林奇综合征的诊断,MMR基因的胚系突变是确诊的金标准。因此,对于临床考虑遗传性结直肠癌的患者,应推荐常规进行MSI/MMR状态以帮助诊断;而对于其他结直肠癌患者,完善MSI/MMR状态的检测可为后续治疗选择提供参考依据。
2、结直肠癌诊断和鉴别诊断相关免疫组化标记物
根据鉴别目的的选取,结直肠腺癌典型的免疫表型为CK7-/CK20+/CDX2+。
细胞角蛋白7(CK7),上皮来源标记,通常在腺癌中表达,腺上皮和移行上皮细胞表达,非上皮来源细胞无表达。胃肠道的腺癌呈阴性。
细胞角蛋白20(CK20)主要存在于正常的胃肠道上皮、尿路上皮和 Merkel 细胞中,在来源的肿瘤上呈阳性反应,但在乳腺癌、肺癌、卵巢非粘液性腺癌则呈阴性反应。该抗体主要用于标记胃肠道及其来源肿瘤。
尾型同源盒 2(CDX2)是一种肠特异的转录因子,能够调节肠上皮细胞的增殖和分化,对于肠上皮的正常形态和功能维持有一定作用。该抗体在结直肠腺癌中呈现较一致的强阳性细胞核表达,具有高度敏感性和特异性,主要用于结直肠腺癌与其他腺癌的诊断与鉴别。
特异 AT 序列结合蛋白 2(SATB2)是与核基质结合区结合的转录因子,在转录调控和染色质重组等过程中具有重要作用。SATB2 在成人下消化道、阑尾、结直肠等上皮细胞和大脑皮层的神经细胞呈强阳性表达,同时 SATB2 也是成骨细胞分化的重要标记物。SATB2 在结直肠癌中有很好的阳性率,其敏感性及特异性较高。
CEA是大肠癌分泌的一组酸性糖蛋白,广泛存在于各种上皮性肿瘤(尤其是腺癌)。一般认为,大肠癌分化程度越低,CEA阳性表达率越高。
Villin,绒毛蛋白,刷状缘的上皮细胞表达,通常肠癌表达阳性。

3、结直肠癌治疗及预后相关标志物
CSCO指南指出抗 HER-2治疗和 NTRK 抑制剂的使用在结直肠癌治疗中得到越来越多的重视。有条件的情况下对标准治疗后失败的结直肠癌患者可以进行 HER-2状态和NTRK基因融合的检测。
HER2 免疫组化检测
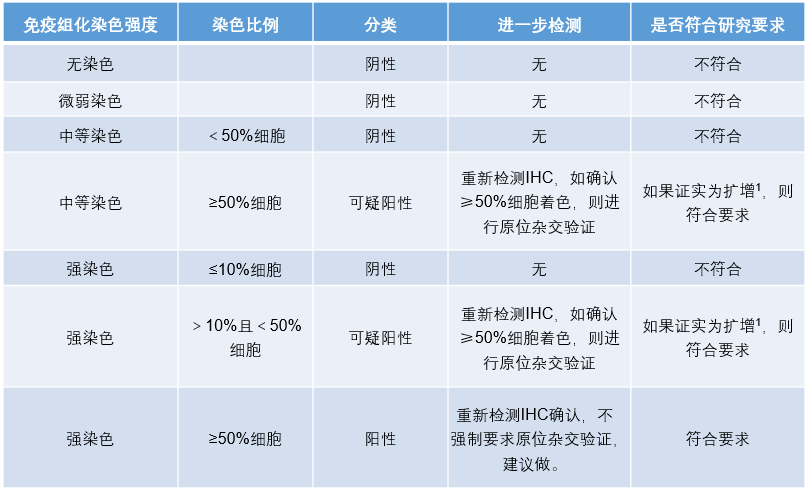
HER2 蛋白是表皮生长因子受体 EGFR/ERBB 家族中的成员之一,是参与细胞生长和分化的信号转导。目前在乳腺癌和胃癌患者中,抗 HER2 治疗的发展比较迅速,在结直肠癌患者中也有一定的研究进展:有研究显示对于 KRAS 2号外显子(12和13号密码子)野生型且 HER2 扩增,并且难以从标准治疗方案中获益的转移性结直肠癌患者,抗 HER2 治疗具有较好的疗效。《2020 CSCO 结直肠癌诊疗指南》建议在有条件的情况下,对标准治疗后失败的结直肠癌患者可以进行 HER2状态的检测,为 Ⅲ 级专家推荐。目前结直肠癌 HER2 的检测和判断标准来自临床研究方案,尚未建立经过权威机构认证作为伴随诊断的检测流程和判读标准。HER2 免疫组化结果判读的标准为(表2)。
(1)阳性:≥50% 的肿瘤细胞呈现细胞膜的基底和侧边或侧边或整个胞膜强阳性着色
(2)可疑阳性,满足下面任何一条:
≥50% 的肿瘤细胞呈现细胞膜的基底和侧边或侧边或整个胞膜中等阳性着色。
>10%且<50% 的肿瘤细胞呈现细胞膜的基底和侧边或侧边或整个胞膜强阳性着色。
(3)阴性,满足下面任何一条:
<10% 的肿瘤细胞呈现细胞膜的基底和侧边或侧边或整个胞膜强阳性着色。
<50% 的肿瘤细胞呈现细胞膜的基底和侧边或侧边或整个胞膜强中等性着色。
无染色或微弱的膜染色。
HER2 免疫组化判读为可疑阳性患者应行 FISH 检测进一步明确 HER2 基因状态,HER2 基因扩增的阳性定义为大于50%的肿瘤细胞 HER2/CEP17 比值≥2.0,其余为阴性。
表2.结直肠癌HER2免疫组化染色结果判读图片
NTRK基因融合在结直肠癌中非常罕见,发生率约为0.35%,仅限于RAS和BRAF野生型的结直肠癌,且绝大多数为dMMR/MSI-H的结直肠癌检测NTRK基因融合的方法有多种,免疫组织化学染色是一种快速、经济的初筛方法,但对NTRK基因融合仍需使用FISH或NGS方法进行验证。
Ki67是一种核蛋白,与细胞增殖有关,其值大小反映了肿瘤细胞的增殖速度。数值越高,说明细胞增生越活跃,肿瘤生长越快,组织分化越差,患者预后越差。
◆总结
综上所述,免疫组化是明确肿瘤良恶性程度如何,以及判断肿瘤是原发还是转移等等问题的有效手段。但是不同癌种,不同分型免疫组化生物标志物不同且数目较多。随着医疗科技的飞速发展,多重免疫组化(mIHC)可以实现在一张切片原位同时检测7-9个靶标,不仅可以实现多因子共定位,获取更多的生物信息,还可以利用软件对组织中的细胞进行精准的结果分析,且样本需求量较少。作为肿瘤病理领域的领军企业,阔然生物一直致力于推广和应用多重荧光免疫组化技术,为临床病理科提供创新且全面的下一代病理(NGP)解决方案,助力病理行业发展进入新时代。
参考文献
[1]中国临床肿瘤学会(CSCO)结直肠癌专家委员会. 结直肠癌分子标志物临床检测中国专家共识[J].中华胃肠外科杂志,2021,24(3):191⁃197.
[2]中国临床肿瘤学会(CSCO)结直肠癌诊疗指南2023
来源:阔然生物
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设