
北京时间1月3日21:30,由全国卫生产业企业管理管理协会医学检验产业分会(CAIVD)、CACLP举办的“中美专家解读FDA新规:LDT监管的重要性”线上访谈圆满举行。本次线上访谈吸引了约1万专业观众在线观看互动。(至文末回看)
参加本次线上访谈的嘉宾有:全国卫生产业企业管理协会副会长、医学检验产业分会会长,上海市实验医学研究院副院长、体外诊断产业发展研究所所长,吉林医药学院、天津医科大学客座教授宋海波教授,上海市实验医学研究院院长、全国卫生产业企业管理协会实验医学分会主任委员、《VIEW》主编王华梁教授,原上海市药品监督管理局医疗器械监管处处长、上海长三角医疗器械产业发展促进会、中国医药保健品进出口商会医疗器械国际合作分会会长林森勇会长,普瑞纯证首席科学家、前北美华人临床化学家协会(NACCCA)王永强教授,罗彻斯特大学病理和检验系教授和系副主任、北美华人临床化学协会前会长、ADLM董事会成员和财务总监张岩教授,凯莱谱科技股份有限公司首席科学官、前北美华人临床化学家协会(NACCCA)主席、前美国最大第三方Quest诊断高级科学总监吴卫甲教授,北京泛生子基因科技有限公司首席医疗官、原美国FDA医疗器械和放射健康中心(CDRH)/体外诊断和放射健康办公室(OIR)分子遗传学与病理学部副主任胡云富教授。
宋海波教授进行了开场致辞,并担任主持人。此次线上访谈围绕五大议题,从FDA监管LDT的动机、规定,对临床实验室和体外诊断行业的影响,以及FDA关于LDT监管的具体规则和计划,新的市场准入要求、质量控制标准等进行了深入剖析。
林森勇会长表示,按照国家药监局的统一布署,为全面建立科学监管体系,上海长三角医疗器械产业发展促进会与全国卫生产业企业管理协会医学检验产业分会将于2024年1月18日在上海联合举办“构建医疗器械科学监管体系,促进长三角医疗器械产业高质量发展”课题研讨会,共同探讨产业相关新模式新发展,其中也将对LDT监管项目进行课题讨论,主要依照先前在上海试点的《定制式医疗器械的监管要求》进行框架研究,由医院作为申请备案主体,再由监管部门对受委托的生产企业进行核查,确保非标准化产品的技术、原材料等在安全规范的体系下生产研发,从而为医院安全快速的临床使用提供了有效的监管。
王华梁教授同时表示,在国内LDT通常是指医学检验部门自行研发、验证和使用的检测方法,仅在医学检验部门内部使用,作为科研用途,不作为商品出售给其它医学检验部门、医院及个人。为了推动国内临床检验相关新技术新项目的创新研发与应用,2021年国家药监局修订了《医疗器械监督管理条例》第53条——对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用,并于2022年年底,国家药监局综合司和国家卫健委又联合发布了《国家LDT试点方案》,从而对形成可复制的LDT管理路径和具体要求奠定了基础。未来,随着国内监管部门在试点方案中不断地探索和实践,相信LDT监管架构将不断地完善和健全。
胡云富教授表示,LDT一般是指实验室内部研发、验证和使用的检测方法。过去,临床实验室使用的IVD试剂盒是经FDA审批的,但美国实验室自主研发的诊断测试大都不经FDA审批。然而美国FDA逐渐意识到LDT的准确性若没有得到充分监督,可能会危及患者安全。这一风险在疫情期间通过EUA紧急使用授权的COVID-19检测性能上得以侧面反映。在一项美国FDA发起的盲测中,不同COVID-19核酸检测的最低检出限(LoD)竟然表现出高达上千倍的误差。由此可见,对临床检测进行更为严格的监管尤为重要,一个更强大的监管框架将有助于确保临床检测的安全有效进行。
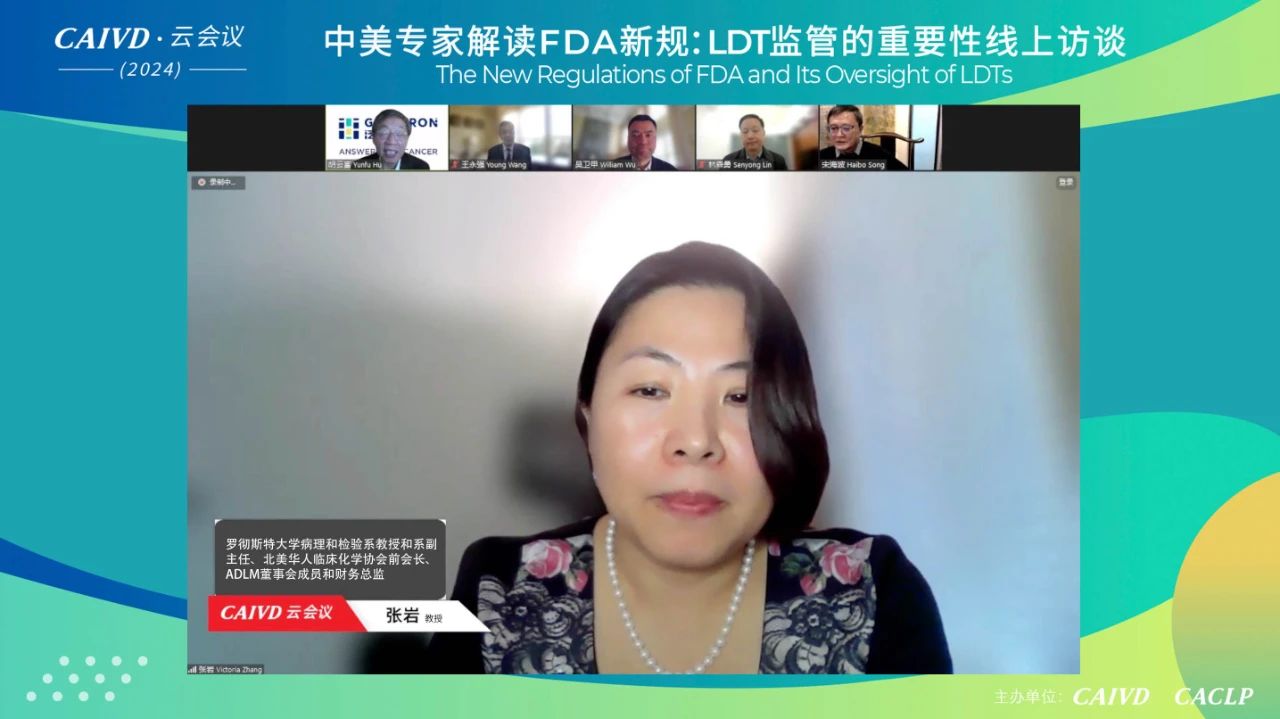
张岩教授表示,临床实验室、学术医疗中心、第三方检验所和CRO中心实验室对美国FDA监管LDT均持保留意见。在美国FDA发布监管LDT的法规修订征求意见之前,医疗保险和辅助服务中心(CMS)依据临床实验室改进修正案(CLIA ‘88)对LDT进行监管,再根据技术复杂度分类进行CLIA认证。而现阶段,美国大部分医疗机构、实验室等对美国FDA的监管能力物力,以及对未来LDT项目庞大审核量的完成都存在质疑,因此呼吁维持由CLIA对LDT的监管,且修订完善CLIA才是可行方案。
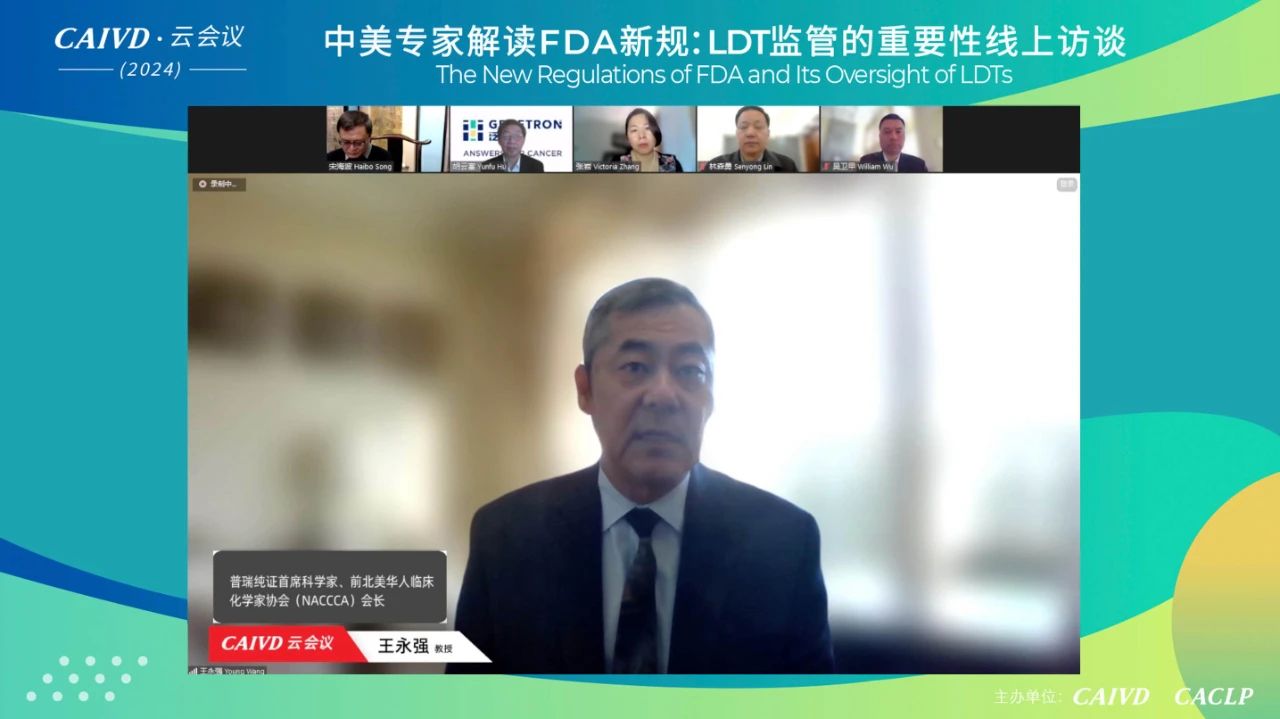
王永强教授表示,自美国FDA在9月29日发布了监管LDT的法规修订征求意见稿以来,临床实验室、学术医疗中心、第三方检验所和CRO中心实验室对其反响都非常巨大,但美国FDA预计在今年4月份将其备受争议的LDT拟议政策立法化。现阶段对于国内的IVD制造商或测试开发商来说,通过LDT途径进入美国市场并不是一个好的机会,主要原因为美国临床实验室数量已经达到一个饱和的状态。然而,也有一些特定创新的LDT项目值得国内IVD企业考虑,比如伴随诊断或能够与药物结合而进行的诊断项目等都不啻为新机。
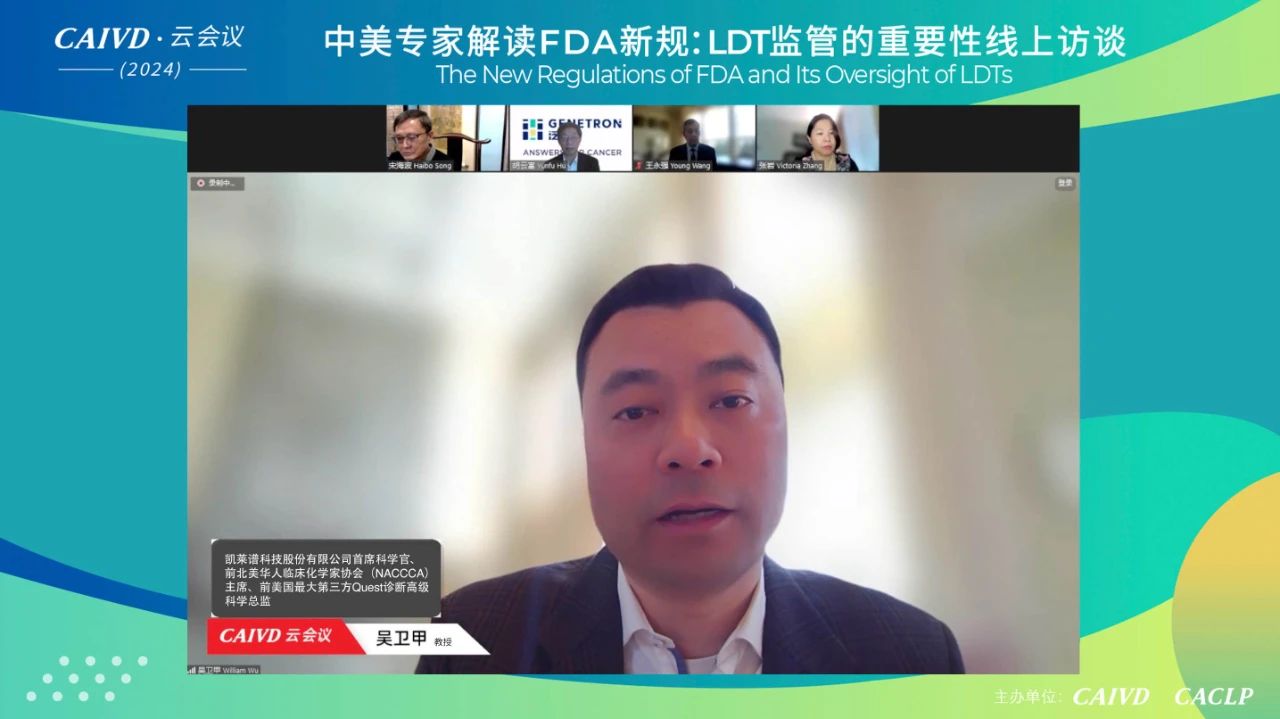
吴卫甲教授表示,美国FDA在制定对LDT的监管规定前会公开讨论和征求意见,并且在最终落实LDT拟定议题后,也表示将会分为不同阶段来对其进行核查,这种透明度与公开性促进了各方合作与共识。并且在监管框架内,美国依然鼓励对技术创新,但要求需符合监管标准——安全、有效,为患者提供更可靠的诊断结果,因此我们可以借鉴这种平衡技术创新与合规性的做法,来不断地推动行业的健康发展。
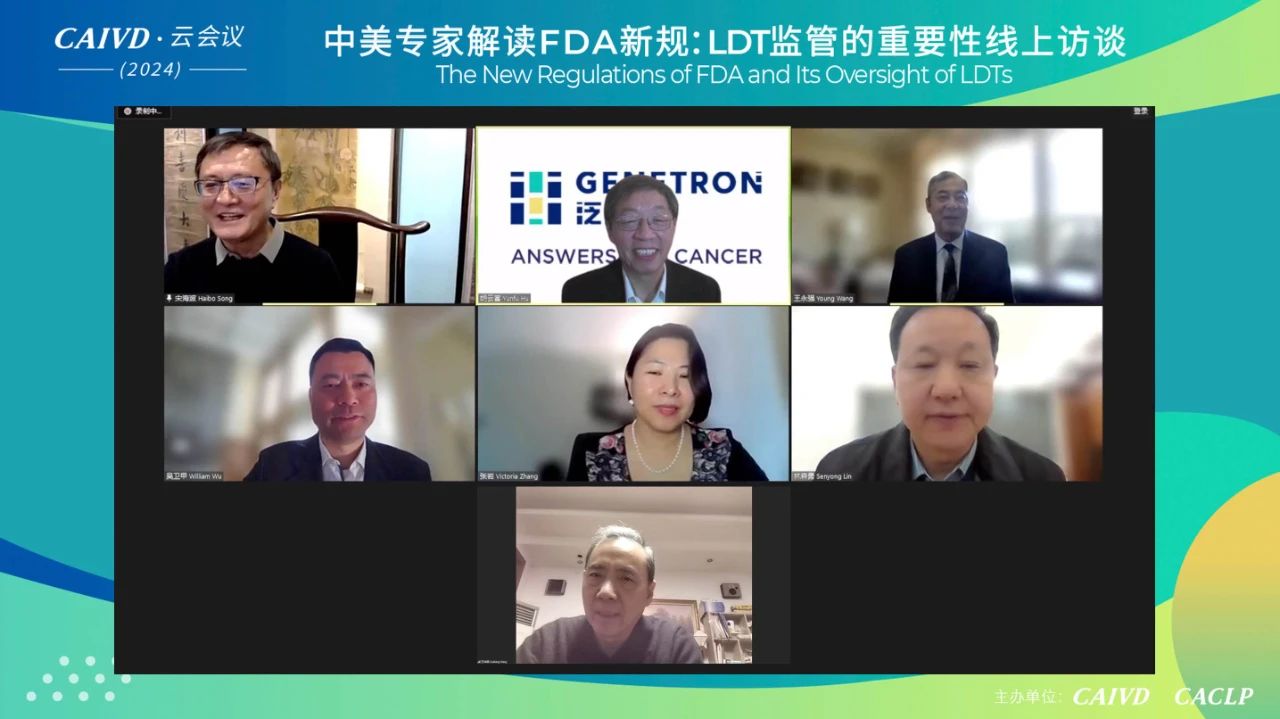
在会议的尾声,专家们与线上观众积极开展了互动提问环节,他们不仅充分分享了对当前LDT监管政策现状的看法,还对中美两国LDT监管的未来发展趋势进行了深入讨论。未来,CAIVD与CACLP将继续加强国际学术与产业间的合作与沟通,共同推动全球体外诊断领域的创新与健康发展。

「下载体外诊断快讯APP二维码,观看回放」
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设