
作者:郁金泰 教授
复旦大学附属华山医院神经内科主任医师,博士生导师
导语
为了提高我国痴呆与认知障碍性疾病的诊疗水平,由中华医学会和中华医学会神经病学分会主办,山东省医学会承办,山东第一医科大学附属省立医院协办的“第九次中国痴呆与认知障碍学术会议”于2023年12月8-10日在山东省济南市召开。会议中来自复旦大学附属华山医院的郁金泰教授就《体液生物标志物在AD早期诊疗中的应用》进行了详细讲解。
据最新的疾病负担数据显示,目前我国有将近1000万的阿尔茨海默病患者和3800多万的轻度认知障碍患者,随着人口结构的老龄化,患者人数在未来的5-10年将持续增长。中国的阿尔茨海默病 (AD) 相关花费在2050年将达到3400亿,对患者及患者家庭乃至整个医疗系统都是十分严峻的挑战1。
AD 早期诊断及生物标志物概览
AD起病隐匿,但中后期进展很快,大约有30%的患者每隔一年会进展到下一个阶段,因此早诊早治、延缓疾病进展至关重要2。研究发现,AD的病理改变是层层递进的,生物标记物的变化远早于认知相关症状的出现3。
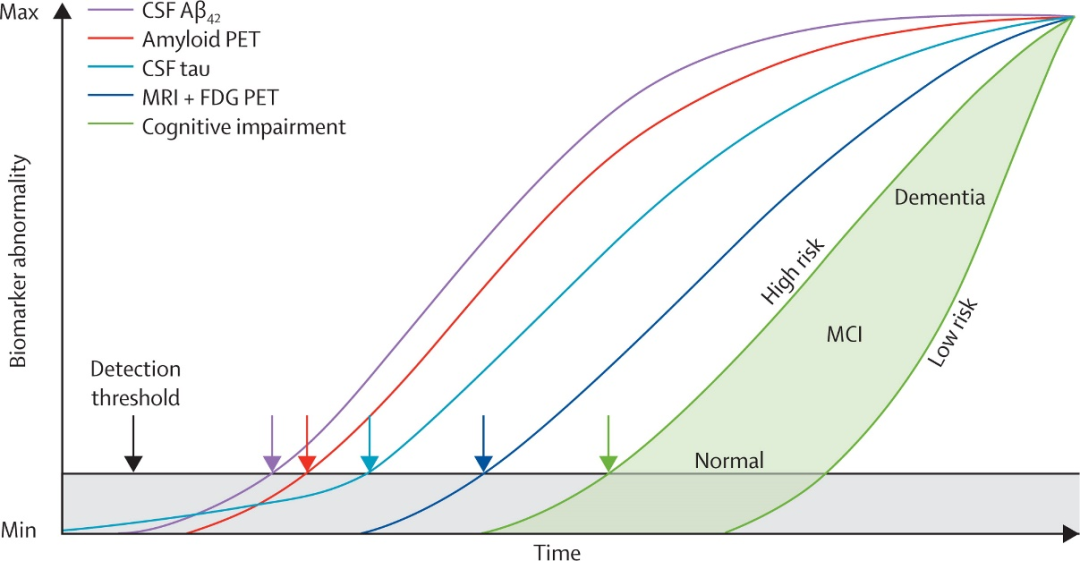
国际指南推荐使用生物标志物辅助AD临床诊断
2018 NIA-AA研究框架4:
首先提出将A/T/N系统作为生物学定义进行研究,指出这些蛋白异常沉积可将AD定义为一个特定的神经变性疾病。2018年1月,FDA推荐今后AD临床试验应用由NIA-AA提出的ATN研究作为诊断标准。同时,ATN标准长期经多项临床病理对照研究,验证了认知损害演变、影像学、脑脊液检查及Aβ-PET和病理的相关性。
IWG 临床指南(2021)5:
推荐使用常见的临床症状(包括海马型遗忘综合征、原发性失语症等)+ Aβ和Tau生物标志物的证据来辅助AD临床诊断。
2023 NIA-AA AD诊断标准(征求意见稿)6:
提供了使用生物标志物来进行AD诊断和分期的最新标准。
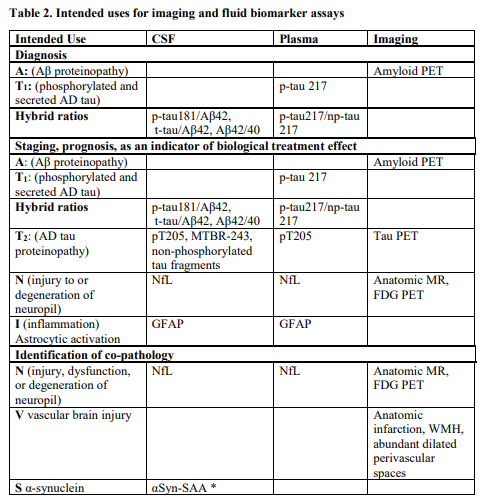
其中,生物标志物分为三大类:核心标志物(核心1, A+T1; 核心 2: A+T2), 非特异性标志物,及非AD共病标志物。核心1的生物标志物定义了可在体内检测到的AD病理表现的最早阶段,因此核心1的生物标志物可以用作于AD诊断的标准,且无论是否出现相关的症状。核心 2的生物标志物常会在AD更晚阶段表现出水平异常,常与症状相关,因此核心2生物标志物不能单独用于诊断,但可以与核心1生物标志物相结合,来提供以下方面的信息:AD相关的可能症状、疾病分期、无症状者病情恶化的风险以及有症状患者病情恶化的可能进展。
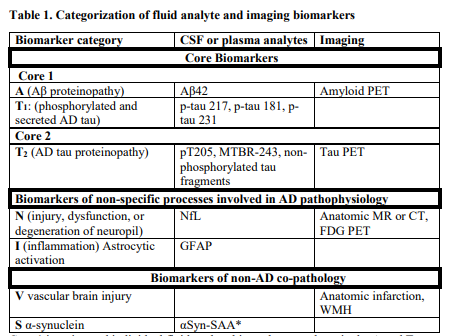
另外对于不同的预期用途,新版也对不同类型的生物标志物进行了进一步细分归类(脑脊液,血浆,影像学生物标志物)。
AD脑脊液生物标志物最新研究进展和应用
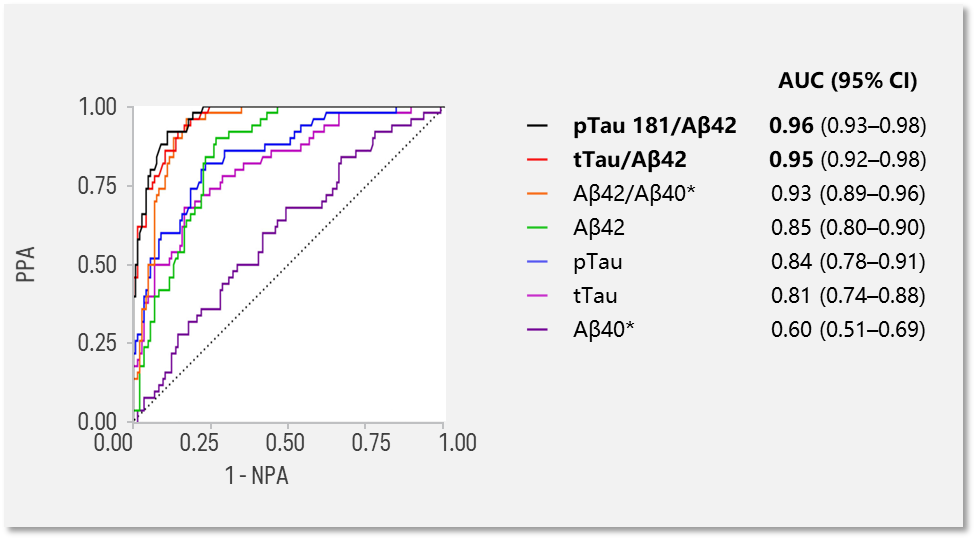
第一,相较于单标志物, 脑脊液(CSF)生物标志物pTau181/Aβ42 比值和tTau/Aβ42 比值 与PET结果一致性方面有显著的优势7。
在一项基于华盛顿圣路易斯大学ADRC 队列中自然衰老和痴呆的社区人群 (N=198)研究显示,CSF pTau181/Aβ42 和CSF tTau/Aβ42与Aβ-PET 结果一致性ROC分别为0.96(0.93–0.98)和0.95(0.92–0.98)。
同时,由于生物标志物的稳定性在临床常规应用中非常重要。我们希望无论使用何种分析系统,同一个样本的检测结果能在空间和时间上具有可比性,为临床提供更为准确可靠的信息。一项基于BioFINDER队列的研究9 (N=227)中,在对于pTau181,Aβ42, Aβ40均引入±10%的理论误差后,pTau181/Aβ42的稳定性依然较好,引入误差后需要重新判定的比例显著性低于Aβ42/Aβ40 (重新分类率: 1.4% vs. 10.5%),这也表明CSF pTau181/Aβ42能更好地辅助判定结果在临界值附近的患者。
第二,CSF pTau/Aβ42比值和CSF tTau/Aβ42比值也具有鉴别诊断的能力。通过对比利时安特卫普大学神经生物样本库的150例样本进行分析,发现在区别AD引发的痴呆和血管性痴呆上,CSF pTau/Aβ42比值 和CSF tTau/Aβ42比值具有更高的敏感性和特异性10。

同时,研究也表明CSF pTau 181/Aβ42比值能更好地辅助鉴别AD和额颞叶变性(FTLD)或其他病理变化。通过对Eginition医院的263例患者数据进行分析,结果显示在区别AD源性痴呆(N=98) 和其他的临床分组(bvFTD行为变异额颞叶痴呆(N=49), PSP进行性核上性麻痹 (N=50), CBD皮质基底节变性 (N=45))时,CSF pTau/Aβ42 和CSF tTau/Aβ42的比值有更高的AUC11。另外一个来自慕尼黑工业大学医院认知障碍中心的130例患者队列的结果也显示CSF pTau/Aβ42在鉴别AD源性痴呆与FTLD上较其他生物标志物标志物有更高的AUC12。
第三,CSF pTau/Aβ42 和tTau/Aβ42 比值均有较高识别高风险进展为AD的能力。一项基于ADNI队列(2019)的研究显示13:基线时CSF pTau 181/Aβ42比值为阳性患者经过两年随访,CDR-SB 的改变(平均升高1.4-1.6)较阴性患者CDR-SB (少于0.5)有十分显著的差异。对于预测6年内转化为痴呆患者的能力,CSF pTau 181/Aβ42和 tTau/Aβ42的能力也更强(Hazard ratio 分别为4.76 和 5.20)。
另外一项通过意大利San Raffaele Scientific Institute队列77例MCI患者数据的研究也同样表明pTau/Aβ42 比值结果能精准预测MCI到AD的转化 (敏感性 83%,特异性 90%)14。
而在一项更大队列的研究(BioFINDER1/2, WRAP , WADRC 队列15,N=1453)中, 研究者比较了认知未受损(CU)进展到AD源性痴呆,MCI进展到AD源性痴呆,及认知未受损进展到全因型痴呆三种情况下,不同生物标志物或生物标志物组合的预测能力(包含:pTau181/Aβ42 , Aβ42/40 , NfL, neurogranin, YKL-40, GFAP, sTREM2, S100b, IL-6,α-synuclein)。结果显示CSF pTau181/Aβ42 比值在三组中都有较好的预测能力,认知未受损参与者和 MCI 患者基线时的CSF pTau181/Aβ42 比值,相较于其他生物标志物或组合,可以最好地预测 AD 痴呆的转化。
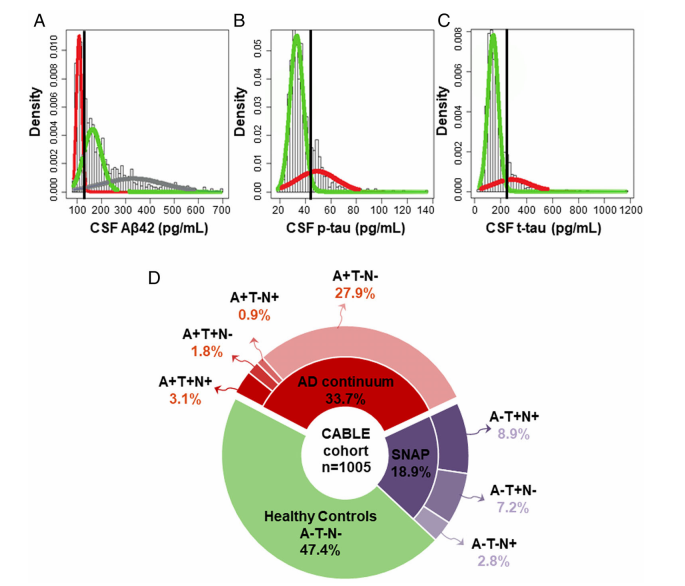
第四, 由于CSF Aβ 和CSF tau 的出现远早于其他类型生物标志物16,上海复旦大学华山医院认知临床团队在2022年通过对CABLE队列(N=1005)进行分析,发现基于CSF的ATN框架的生物标志物能十分有效的诊断临床前AD (preclinical AD)17。
AD血液生物标志物研究进展和临床价值
第一,血浆标志物p-Tau 181和p-Tau 217可以鉴别AD与其他类型痴呆,其精准诊断能力需要进一步评估。血浆(pTau181、pTau217 或 pTau231)浓度都与临床诊断的AD密切相关。血浆p-Tau 217可以将AD 与其他神经退行性疾病区分开来,其准确度显著高于血浆p-tau 181和血浆NFL19。
第二,血浆GFAP有更好的潜力能成为AD早期诊断的生物标志物。华山认知临床团队通过对于818例患者(随访210例)进行大规模横断面和纵向人群分析研究发现,GFAP早在临床前AD阶段Aβ病理出现时就已经显著升高,随着疾病进展,当tau病理和认知损伤出现后,该蛋白的含量会逐渐上升,直至AD痴呆阶段达到最高水平。这提示血浆GFAP可作为AD诊断和预测的生物标志物,且可用于预测AD的临床进展,是AD早期临床诊断和发病预测的辅助工具20。

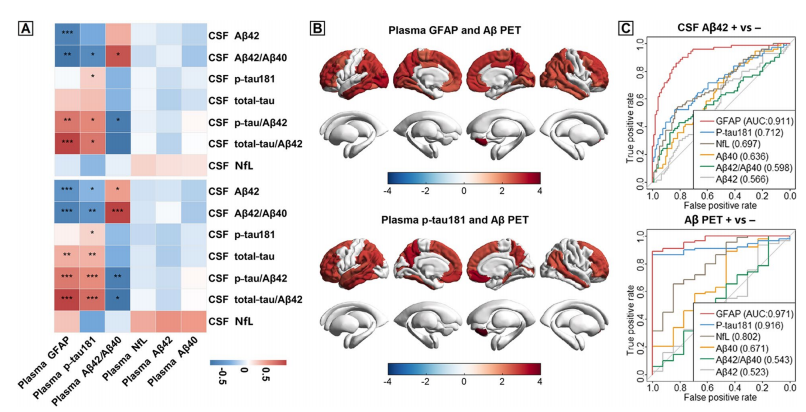
同时,血浆GFAP可以更精确地识别AD病理。另一项华山认知临床团队的研究中显示,通过比较Aβ42/Aβ40、Aβ42、Aβ40、p-Tau181、NfL和GFAP五种外周血浆生物标志物在AD全病程中的变化情况及识别AD病理的能力,发现血浆GFAP最先发生变化。研究还显示,只有GFAP和p-tau181与脑部广泛区域的淀粉样示踪剂摄取呈显著正相关。此外,血浆GFAP可以准确地区分脑脊液Aβ42(AuC=0.911)和Aβ-PET(AuC=0.971)状态,血浆p-tau181在区分Aβ-PET状态方面也表现良好,AUC值为0.916,而对于其他血浆生物标志物,识别准确率都相对较低21。
血液标志物(Blood-Based Biomarker, BBBM)将会成为AD诊疗路径中不可或缺的部分。目前尚未有针对 AD 的外周血检测获得FDA批准,未来期待BBBM可应用于 AD 病理的早期检测,缩短诊疗时间,成为 AD 转诊路径中重要的工具22。
世界上每3秒钟就有一个人患上阿尔茨海默病,我国作为全球AD患者数量最多的国家,在60岁及以上人群中约有1000万名AD患者。随着老龄化程度的加深,“早诊早智”显得尤为关键。及时识别 AD 的危险因素、症状和警告信号,利用不同的生物标志物辅助AD的诊断,鉴别诊断、预测疾病进展和早期疾病谱分期,将愈加重要;未来期待大家共同参与到AD和认知障碍相关的工作中,共同助力健康的老龄化社会。
参考文献:
1.Nandi A, et al. EclinicalMedicine 2022;51:101580.
2.Davis M, et al. Curr Alzheimer Res 2018;15:777–88.
3.Jack CR Jr, et al. Lancet Neurol 2013;12:207–16.
4.Jack CR, et al. Alzheimer's Dement 2018;14:535–62.
5.Dubois B, et al. Lancet Neurol 2021;20:484–96.
6.https://aaic.alz.org/nia-aa.asp#workgroup
7.Schindler SE, et al. Alzheimer's Dement 2018;14:1460–9.
8.Rabe C, et al. Alzheimers Dement. 2023;19:1393-402.
9.Logan C, et al. Poster presented at the 15th Clinical Trials on Alzheimer's Disease (CTAD) congress; 29 November–02 December 2022; San Francisco, CA, USA.
10.Struyfs H, et al. J Alzheimers Dis. 2015;45:813-22 and supplementary table 5.
11.Constantinides VC, et al. Diagnostics. 2023;13:783.
12.OrtnerM, et al. J Prev Alzheimers Dis. 2022;9:491-98.
13.Blennow K, et al. Sci Reports. 2019;9:19024.
14.Santangelo R, et al. Eur J Nucl Med Mol Imaging. 2020;47:3152-64 .
15.Salvadó G, et al. Alzheimers Dement. 2023.
16.Wang H-F, Shen X-N, Li J-Q, et al. Alzheimers Dement. 2020;12: e12095.
17.Hu, H., Yu, J.-T. (2022), Ann Neurol, 92: 439-450.
18.Snyder H M, et al. Alzheimer's & Dementia, 2014, 10(1): 109-114.
19.Palmqvist S, et al. JAMA 2020;324:772–781.
20.Shen X N, Yu JT, et al. Clinical Chemistry, 2023, 69(4): 411-421.
21.Guo Y, Yu JT, et al. Alzheimers Res Ther. 2023 Feb 8;15(1):31.
22.Hansson O, et al. Alzheimers Dement 2018;14:1470–81.
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设