
推荐单位:中国生物医学工程学会类器官与器官芯片分会,中国医药生物技术协会基因检测技术分会
通信作者:席建忠 (1974-),山西朔州人,教授,博士生导师,主要从事肿瘤精准医学研究。E-mail:jzxi@pku.edu.cn;
季加孚 (1959-),内蒙古呼和浩特人,教授,博士生导师,主要从事胃癌临床与转化研究。E-mail:jijiafu@hsc.pku.edu.cn
基金项目:国家自然科学基金项目 (82150005);北京协和医院中央高水平医院临床科研专项2022年专科提升计划项目 (2022-PUMCH-B-005)
DOI:10.12287/j.issn.2096-8965.20230414
【摘要】
患者来源类肿瘤细胞簇 (Patient-Derived Tumor - Like Cell Cluster,PTC) 简称微肿瘤或微肿瘤 PTC,是一种新型的原代3D肿瘤模型,该模型在病理组织学特征、分子遗传学特征方面保持了跟原始肿瘤组织的高度相似性。同时,该模型在培养过程中保留了原始肿瘤组织中的成纤维细胞和免疫细胞,从而高度还原了原始肿瘤组织微环境特征。微肿瘤PTC模型可广泛的应用于肿瘤基础科学研究、精准治疗和新药研发等领域。然而,由于微肿瘤PTC模型的构建及应用涉及到多种技术,流程多,影响因素多,目前,国内对微肿瘤PTC模型构建、鉴定、药敏检测等操作尚未建立规范标准。为此,特组织编写《微肿瘤模型构建及药敏检测技术中国专家共识 (2023年版)》,以利于推动和指导微肿瘤PTC模型构建以及基于此模型药敏检测技术的应用。
【关键词】 微肿瘤PTC;肿瘤;肿瘤药敏检测;共识
0
引言
根据美国癌症学会 《2022 年全球癌症统计数据》 显示,癌症仍然是威胁人类健康的重大疾病[1]。虽然测序等各种组学技术的快速发展加速了对癌症发病机制的了解以及癌症创新医药的研发,但由于不同个体、同一个体不同时期肿瘤的生物学特征和生物学行为存在较大差异,使得肿瘤临床治疗和新药研发面临较多不确定性。
体外肿瘤模型,尤其是源自患者的原代肿瘤模型是开展肿瘤研究以及服务患者个体化精准治疗的重要工具。目前,研究者已开发了多种类型的体外肿瘤模型,包括 2D 培养的肿瘤细胞系和患者来源的肿瘤移植瘤模型 (Patient -Derived Tumor Xeno‐graft,PDX)。这些模型在肿瘤基础研究、转化应用领域得到了广泛的应用。但是,肿瘤细胞系在体外培养的传代培养过程中,病理特征和遗传特征已经发生了巨大改变[2]。而PDX模型虽然在分子生物学、组织学和病理学特征等方面较好地保持了与原始肿瘤的一致性[3],但其在传代过程中,人的基质细胞会逐渐被小鼠基质细胞替代,导致肿瘤微环境失真,从而影响研究结果的准确性[4-5]。此外,建模成功率和时间的影响也限制了 PDX 模型在个体化精准医疗中的应用。
近年来,随着生物工程技术的发展,新一代的临床前体外 3D 肿瘤模型逐渐涌现,此类模型特点是抛弃传统 2D 培养方式,以基于支架或无支架方式在体外进行3D肿瘤培养。目前,3D肿瘤模型中较 为 突 出 的 是 肿 瘤 类 器 官 (Patient - Derived Organoids,PDO)。PDO在较大程度上保留了原始肿瘤组织的分子遗传学特征、表观遗传学特征及病理特征,可一定程度上再现肿瘤细胞的异质性[6]。但是,目前 PDO 培养方法多种多样,尚未形成统一规范,且培养成本高,临床转化应用尚存在局限。另一种基于自组装悬浮 3D 培养的肿瘤模型,即患者来源类肿瘤细胞簇 (Patient-Derived Tumor-Like Cell Cluster,PTC),简称微肿瘤或微肿瘤PTC,因其高肿瘤保真性、标准化培养和周期短等特点,逐渐凸显出在临床转化应用中的优越性,有望更好地服务于肿瘤患者,实现临床个体化精准用药[7]。
以微肿瘤 PTC 模型为基础的药敏检测技术可为临床制定个体化精准用药方案提供依据,提高患者的临床获益。为了推动微肿瘤 PTC 模型以及基于该模型的药敏检测技术在基础科研、转化医学以及临床诊疗中的应用,中国生物医学工程学会类器官与器官芯片分会组织国内外相关领域专家,基于目前国内外研究报道制定本专家共识。微肿瘤PTC模型及其药敏检测技术尚处于快速研发阶段,其技术细节仍在不断完善的过程中。因此,后续将会根据研究进展,对本共识进行修订。
1
微肿瘤PTC模型概述
微肿瘤PTC是一种新型无需水凝胶支架、且基于患者来源的体外原代 3D 肿瘤模型。微肿瘤 PTC是将患者来源的新鲜肿瘤样本在体外经单细胞化处理,在低黏附培养皿中采用微肿瘤PTC专用培养基悬浮培养 2-7天,以肿瘤细胞为主的多组分细胞自组装聚集形成的3D肿瘤微球,此类3D肿瘤微球质地均匀、形态近似球状、直径在 40~300 μm[7]。微肿 瘤 PTC 模 型 的 培 养 技 术 是 在 传 统 肿 瘤 微 球(Sphere) 的培养基础上[8-9],通过对比分析传统体外培养的肿瘤微球与其配对原始肿瘤组织之间关键信号通路的差异,针对影响生长、细胞相互作用等的关键信号分子,通过添加生长因子或抑制剂来优化培养条件,使得原代肿瘤细胞能够快速增殖的同时与微环境细胞自组装形成3D微球,此类3D微球被称为微肿瘤 PTC。该技术的核心主要在于两方面,一是采用温和细胞解离试剂处理患者肿瘤组织,从而最大程度保证组织中肿瘤细胞以及微环境细胞组分的活力;二是根据肿瘤类型,配制特殊无血清培养基,利用悬浮培养体系对消化获得肿瘤单细胞悬液进行体外培养。由于不同类型肿瘤的组织特征、细胞表型、微环境特征存在一定差异,因此,微肿瘤 PTC 模型培养需要针对不同类型的肿瘤开发专用培养基及相应的组织解离体系。目前已公开的数据显示,研究人员已针对胃癌[7]、结直肠癌[7]、乳腺癌[7]、肺癌[10]、胆囊癌[11]、脑肿瘤[12]、宫颈癌[13]、卵巢癌[13]、子宫内膜癌[13]、尿路上皮癌[14]、骨与软组织肉瘤[15]等多种实体肿瘤类型建立了微肿瘤 PTC 模型培养条件,与此同时也在积极开发更多类型肿瘤的培养体系,包括一些罕见肿瘤类型。
专家共识 1:微肿瘤 PTC模型是将患者来源新鲜肿瘤组织样本,经单细胞化处理后在低黏附培养皿和微肿瘤 PTC 专用培养基中悬浮培养,以肿瘤细胞为主的多组分细胞自组装聚集形成形态近似球体、直径在 40~300 μm 的 3D 肿瘤微球,即为患者来源类肿瘤细胞簇 (Patient - Derived Tumor - Like Cell Cluster,PTC),简称为微肿瘤或微肿瘤 PTC。根据科研和临床需要,推荐胃癌、结直肠癌、乳腺癌、肺癌、胆囊癌、脑肿瘤、宫颈癌、卵巢癌、子宫内膜癌、尿路上皮癌、骨与软组织肉瘤开展微肿瘤PTC模型培养。
2
微肿瘤PTC模型的特点
微肿瘤 PTC 模型培养所需要的样本量少,最少仅需20 mg患者来源的新鲜组织样本,样本类型涵盖了手术切除肿瘤组织、穿刺活检组织、内镜活检组织以及胸腔/腹腔恶性积液等,较高程度上满足了科研和临床应用需求[7]。来自新鲜肿瘤组织样本或肿瘤恶性积液的单细胞成分在微肿瘤 PTC 培养体系中,培养2-7天即会形成3D肿瘤微球,培养周期相较于目前 2D 或其他 3D 体外原代肿瘤模型短,且微肿瘤 PTC 的培养成功率整体可达 85%以上[7]。
体外肿瘤模型技术的关键在于此类模型能够在体外真实模拟患者体内肿瘤的生物学特征[16-17]。因此,针对微肿瘤 PTC 模型,研究人员开展了多方面的特征检测[7,10]。目前,通过苏木精-伊红染色、免疫组织化学染色、免疫荧光检测以及基因测序从细胞形态学、组织病理学以及分子遗传学等多方面证实,体外培养获得的微肿瘤 PTC 模型保持了与原始肿瘤组织的高度相似性[7,10]。苏木精-伊红染色显示体外培养的微肿瘤 PTC 与原始肿瘤组织在病理学特征上保持了相似性[7,10]。针对特定肿瘤中重要的肿瘤标志物,例如乳腺癌的雌激素受体、孕激素受体和人表皮生长因子受体2 (Human Epidermal Growth Factor Receptor 2,HER2) 的表达水平,微肿瘤 PTC 模型也保持了与原始肿瘤组织的高度一致[7]。从基因测序对微肿瘤 PTC基因组特征的分析显示,该模型较高程度上保留了原始肿瘤组织关键基因变异信息[7]。此外,微肿瘤 PTC模型中包含多种肿瘤组织来源的细胞类型,包括肿瘤上皮细胞、成纤维细胞、间质细胞、肥大细胞、巨噬细胞、自然杀伤细胞、T 细胞、B 细胞等,在一定程度上模拟了原始肿瘤微环境特征[7]。但在目前的培养体系中,微肿瘤 PTC 模型虽然含有内皮细胞,但并不能形成血管,因此,不能完全反应原始肿瘤组织中的血管系统特征。
专家共识 2:微肿瘤 PTC模型保留了原始肿瘤的组织病理学特征、分子遗传学特征等表型,同时该模型中保留了多种肿瘤微环境细胞组分,在一定程度上模拟了肿瘤微环境特征,高度还原了患者体内肿瘤细胞与微环境细胞真实的相互作用情况。针对微肿瘤 PTC 培养技术成熟的癌症类型,推荐临床手术切除样本、穿刺活检、内镜活检以及恶性积液样本进行微肿瘤PTC模型培养。
3
微肿瘤PTC模型的质量控制
3.1 肿瘤组织采集、保存、运输注意事项
肿瘤样本采集、保存、运输过程的质量控制对于微肿瘤 PTC 模型培养至关重要,直接影响微肿瘤 PTC 模型的培养成功率。微肿瘤 PTC 培养基于肿瘤患者的组织样本,涉及个人信息和生物样本数据信息等,因此,在样本采集前应在充分告知、尊重供者权利的前提下获得患者知情同意书。临床肿瘤样本需要专业技术人员在无菌条件下采集获取。针对不同类型肿瘤样本所需的大小略有不同,对于手术切除样本建议重量≥20 mg;对于穿刺活检样本建议至少穿刺 2 条且每条长度≥1 cm;对于内镜活检样本建议至少获取 2块且每块直径≥2 mm;对于恶性肿瘤积液样本根据肿瘤细胞含量而定,建议不少于 100 mL。样本采集过程中,应尽量缩短组织样本离体时间,以保证组织样本中的细胞活力并减少污染。此外,由于手术切除肿瘤样本中常包含一些坏死组织、癌周组织等,因此,在取样时应严格注意采集部位为新鲜癌组织区域。
采集获得的手术切除样本、穿刺活检和内镜活检样本,应在采集后立刻保存于含 5 mL 样本保存液的无菌保存管中。胸腹水恶性肿瘤积液等液体样本应用无菌引流袋保存。采集获得的肿瘤样本需低温 (2℃~8℃) 保存,并在此条件下24 h内运输到实验室。实验室在收到样本后,需尽快开展样本的消化处理和微肿瘤 PTC 模型构建,并及时记录样本相关临床资料、收样状态等相关信息。
专家共识 3:拟进行微肿瘤 PTC培养的新鲜肿瘤样本必须是包含活的肿瘤细胞、新鲜无污染的临床样本,取样过程需在无菌环境下进行,避免微生物污染。采集的活检样本不少于2条/块,手术切除样本重量≥20 mg,恶性积液体积≥100 mL。活检和手术切除样本取样后需立即放置于微肿瘤 PTC 专用保存液中。所有样本均需在 2℃~8℃条件下于24 h内运输到实验室。
3.2 微肿瘤PTC模型质量评估
由于不同癌种、同一癌种不同病理学类型以及不同临床样本类型的细胞组分、细胞活力存在一定差异,因此,微肿瘤 PTC 培养成功率也存在一定差异。恶性肿瘤积液进行微肿瘤 PTC 培养的过程中,一般2-3天即可观察到已完成自组装的3D肿瘤微球[7]。包含手术切除组织、活检组织等在内的实体肿瘤类型样本在经过单细胞化处理后进行培养,一般 2-3 天即可观察到微肿瘤 PTC 的形成,最长 7天即可完成 3D 微球自组装过程[7]。因此,在微肿瘤 PTC 的培养过程中,如 7 天内始终无 3D 微球的形成则表明微肿瘤PTC模型培养失败。
构建成功的微肿瘤 PTC 在用于后续实验之前需进行特征鉴定和质量评估。在某一类癌种初次开展微肿瘤 PTC 模型构建时,可通过基因组测序、转录组测序、特异性免疫荧光或流式细胞术、病理检测等多方面的技术手段对微肿瘤 PTC 模型的分子遗传特征、肿瘤微环境特征、组织病理特征等进行表征,分析其与原始肿瘤组织的相似性;针对微肿瘤 PTC 模型培养技术已成熟、且已经通过测序等多技术手段与原始肿瘤组织进行了相似性分析的癌种,则不必每次培养均开展以上检测。通过苏木精-伊红染色和免疫组织化学染色可分析微肿瘤PTC中肿瘤细胞的含量比例、细胞形态特征、病理标志物水平以及关键生物标志物状态,以明确体外培养的微肿瘤 PTC 模型准确保留原始肿瘤组织关键病理特征[7,10]。原代肿瘤培养中微生物污染是一项不确定因素,且已有研究表明,微生物污染严重影响细胞生物学实验的准确性和可重复性[18]。因此,培养成功的微肿瘤 PTC需开展微生物检测,包括细菌、真菌、支原体,确保培养物中不存在以上微生物污染,方可用于后续科研或药敏检测等试验。
专家共识 4:肿瘤单细胞悬液在 PTC专用培养基中培养 2-7 天,即可观察到 PTC 肿瘤微球的形成。如7天内始终无PTC肿瘤微球的形成则表明培养失败。特定癌种微肿瘤 PTC 模型培养技术建立之初,应通过基因组测序、转录组测序、免疫荧光、IHC等多技术手段鉴定表型。每一个成功构建的微肿瘤 PTC 开展细菌、真菌、支原体检测以排除微生物污染,微生物检测阴性的微肿瘤 PTC 样本方可应用于后续科研或药敏检测试验。
4
基于微肿瘤PTC的药敏检测
随着科学技术的不断发展,肿瘤临床治疗手段日趋多样化,但药物治疗仍是肿瘤治疗中必不可少的手段。虽然以二代测序 (Next Generation Sequencing,NGS) 为主的基因检测技术为肿瘤患者个体化精准用药提供了重要支持[19-21],但NGS检测主要局限在指导靶向药物的临床应用,而针对肿瘤治疗中广泛应用的化疗药物,以及以免疫检查点抑制剂为代表的新兴免疫治疗药物的临床用药方面,现有 NGS 技术的指导价值有限。同时,在临床实际用药中,接受单一药物治疗的患者较少,大部分患者的治疗方式为多药物联合治疗,包括化疗药物联合、化疗联合靶向、免疫联合化疗等,此类联合治疗方式缺乏明确标志物进行疗效预测。此外,肿瘤演进过程中具有较高异质性,使得不同时期肿瘤细胞的生长速度、侵袭能力以及对抗肿瘤药物的敏感性具有较大差异,为肿瘤临床治疗带来重大挑战[22]。因此,近年来,基于患者个体的原代肿瘤模型开展体外抗肿瘤药物敏感性检测以提前预测临床疗效的技术开始受到广泛关注[23-25]。
微肿瘤 PTC 模型具有所需样本量少、培养周期短、培养成功率高、且高度保留了原始肿瘤组织特征,是开展抗肿瘤药敏检测的理想模型[7]。微肿瘤 PTC 药敏检测基本原理是基于患者个体肿瘤样本,通过体外实验手段检测其对不同抗肿瘤药物的敏感性程度,该过程涉及从医院到检测实验室的多方面流程。基于微肿瘤 PTC 模型,可预测靶向肿瘤细胞产生细胞毒性作用的药物疗效,包括化疗药物 (见附件一) 和部分靶向药物 (见附件二) 等。在微肿瘤 PTC 模型中,可对单一化疗/靶向药物以及化疗/靶向药物联合的敏感性进行预测,可通过对比不同药物或不同药物组合对肿瘤 3D 微球的杀伤效率差异,提前预判不同药物治疗方案在患者个体中可能产生的疗效,从而为患者用药选择提供参考。在微肿瘤 PTC 模型中开展抗肿瘤药物敏感性检测时,需全面了解待检测药物的抗肿瘤杀伤原理和作用靶点,从而明确检测结果的临床参考意义。针对部分需经过体内代谢产生抗肿瘤活性的化疗药物 (如卡培他滨等),利用微肿瘤 PTC开展药敏检测时应采用其活性成分,如 5-FU 代替卡培他滨等[26]。此外,微肿瘤PTC模型不具备模拟体内肿瘤血管系统特征,不能预测抗血管靶向药物的临床疗效,因此不推荐应用于此类抗肿瘤药物的敏感性检测。目前,基于微肿瘤 PTC 模型的药敏检测技术已开展多项大型临床研究。根据已发表的临床试验数据显示,基于微肿瘤 PTC 模型开展的药敏检测体系预测胃肠肿瘤药物临床疗效的准确性达到了96.6%[7], 预 测 乳 腺 癌 临 床 疗 效 的 准 确 性 可 达91.4%[7],预测肺癌药物临床疗效的整体一致率也超过 89.0%[10]。这些研究表明,基于微肿瘤 PTC 模型的药敏检测技术在指导肿瘤患者个体化精准用药方面具有广泛的临床应用前景。
专家共识 5:鉴于微肿瘤 PTC模型生物学特征与原始肿瘤的高度相似性,推荐此模型用于抗肿瘤药物敏感性检测。可检测药物包括化疗药物和部分抗肿瘤靶向药物 (具体信息参见附件),检测方式可以是单药也可以是化疗药物或者靶向药物的组合。但由于微肿瘤 PTC 模型不可模拟体内代谢环境,在进行抗肿瘤药物敏感性检测前,需具体分析药物的作用机制及作用靶点。微肿瘤 PTC 模型中缺乏血管系统,不推荐利用此模型检测抗血管生成药物的敏感性。
5
微肿瘤PTC药敏检测技术操作要点
微肿瘤 PTC 模型的 3D 微球源自肿瘤细胞以及肿瘤基质细胞的自发聚集、组装,因此,同一患者来源组织培养获得的微肿瘤 PTC 体系中不同 3D 微球的细胞组分和表型特征不尽相同。在该背景下,为确保基于微肿瘤 PTC 模型开展的药敏检测结果的准确性和可重复性,研究人员开展了大量的论证工作[7]。将培养成功的 PTC 肿瘤微球按照 1~5 个、5~10 个、10~30 个、30~50 个或 50~100 个接种于细胞培养孔中,分析药敏检测结果的变异系数。结果显示,每个实验孔中至少加入 30~50 个 PTC微球时,药敏检测结果变异系数<0.2[7]。此外,研究人员对于药敏试验复孔设置也进行了相应验证,每个药物方案需设置不少于3个重复可更好地确保实验结果的可重复性[7]。通过这些研究,确保了微肿瘤 PTC 药敏检测结果的可靠性。此外,研究人员针对微肿瘤 PTC 药敏检测技术建立了一套基于深度学习的人工智能细胞图像识别系统,利用此类图像识别系统判读微肿瘤 PTC药敏检测结果[7],简化操作步骤的同时进一步减少了人为操作可能引入的结果误差。为确保基于图像识别系统结果判读的准确性,在接种 PTC 肿瘤微球的操作过程中,切忌产生大量气泡,以避免影响肿瘤微球图像的拍摄和表面积智能识别,造成检测结果偏差。
专家共识 6:基于 PTC 肿瘤微球的异质性特点,为保证药敏检测结果的准确性和可重复性,利用微肿瘤 PTC开展药敏检测实验需设置平行对照,同时每种药物方案的检测需设置不少于 3 个重复孔,且需保证每个实验孔中的 3D 肿瘤微球数量在30~50 个。推荐微肿瘤 PTC 药敏检测采用人工智能细胞图像识别系统来判定结果,运用此类检测系统需注意接种 PTC 微肿瘤的操作过程中,切忌产生大量气泡影响结果判读。
06
微肿瘤 PTC模型及其药敏检测技术应用前景
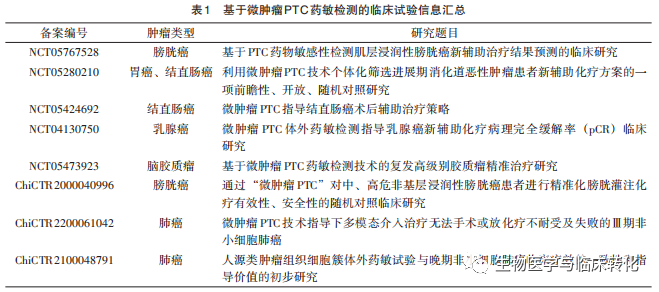
基于患者来源体外肿瘤模型开展药物敏感性检测的技术在服务肿瘤个体化、精准治疗方面具有重要意义和临床应用价值。目前,基于患者来源肿瘤类器官模型的药敏检测的临床应用研究已有较多报道,初步证实了此类技术能够在一定程度上预测肿瘤患者的临床药物治疗疗效[27-28],相关研究覆盖了大多数实体肿瘤类型,同时涉及肿瘤进展不同时期的患者和临床治疗进程的不同阶段。微肿瘤PTC模型以及相应药敏检测技术体系相较于类器官技术起步略晚,但已在培养周期、药敏检测周期、操作标准化、临床疗效预测准确性等多方面展现出不俗表现[7,10]。微肿瘤PTC药敏检测技术可服务于不同肿瘤类型、不同进展时期以及不同治疗时期的肿瘤患者,通过代替患者的“体外试药”方式为临床治疗选择提供参考。目前,多项针对微肿瘤PTC药敏检测技术在不同实体肿瘤中的应用安全性和有效性的前瞻性临床研究正在进行中(见表1)。NCT05280210是一项前瞻性、开放、随机对照研究,该研究针对病理诊断为腺癌的局部进展胃癌、非低位结直肠癌及肠癌肝转移患者,拟比较基于微肿瘤PTC药敏检测结果进行新辅助化疗的患者与采用经验性辅助化疗方案的患者病理有效率的差异。NCT05424692是一项前瞻性多中心、随机对照研究,旨在针对中及中晚期可实施根治性手术且需进行术后辅助化疗的结直肠癌患者,评价微肿瘤PTC药敏检测结果与临床预后的一致性,探索微肿瘤PTC药敏检测技术应用于辅助结直肠癌精准治疗的决策价值和指导意义。NCT04130750/NCT04131881 临床研究拟探索微肿瘤PTC药敏检测技术指导乳腺癌新辅助化疗病理完全缓解率 (pathologic Complete Response,pCR)。NCT05473923 研究针对复发高级别脑胶质瘤患者,旨在为包括复发胶质瘤在内的高级别胶质瘤的精准治疗临床实施提供依据,以期改善患者生存和预后。NCT05767528 研究拟在基层浸润性膀胱癌患者中,分析微肿瘤PTC药敏检测结果与患者临床治疗疗效的相关性,评估微肿瘤PTC药敏检测预测膀胱癌临床治疗疗效的准确性。相信随着以上临床试验的相继完成和结果公布,将进一步明确微肿瘤PTC药敏检测技术可介入临床治疗的最佳时期和可获益患者群体,为微肿瘤PTC药敏检测技术在临床用药指导中的应用提供更高级别的循证医学证据。
7
总结
微肿瘤 PTC 模型是一种新型的基于患者来源的、无水凝胶支架培养的原代 3D 肿瘤微球,其高度模拟了患者体内肿瘤的多种生物学特征和表型,并在一定程度上重塑了包含免疫特征在内的肿瘤微环境特征。因为,微肿瘤 PTC 的药敏检测结果在一定程度上反应了复杂肿瘤环境对药物的敏感性,有望为免疫治疗相关药物的敏感性预测引入新的技术手段。目前,微肿瘤 PTC 模型及其药敏检测技术的应用主要集中在乳腺癌、肺癌和消化道系统肿瘤,但在其他实体肿瘤中的应用也在加速推进的过程中。随着国内外研究的不断深入以及微肿瘤PTC技术的不断优化,将为广泛的实体肿瘤以及一些罕见类型肿瘤提供科学研究和个体化精准治疗支持。本专家共识也将随着微肿瘤 PTC 技术的革新逐渐完善修订。
(参考文献略)
《微肿瘤模型构建及其药敏检测技术中国专家共识 (2023年版)》编写专家组
组 长:
季加孚 (北京大学肿瘤医院)
席建忠 (北京大学未来技术学院)
编写专家 (按姓氏汉语拼音排序):
蔡志刚 (北京大学口腔医院);曹宝山 (北京大学第三院);陈晋峰 (北京大学肿瘤医院);樊征夫 (北京大学肿瘤院);季 楠 (首都医科大学附属北京天坛医院);江仁兵 (新疆医科大学附属肿瘤医院);姜丽岩 (上海交通大学附属胸科医院);李宏召 (中国人民解放军总医院);李 华 (首都医科大学附属北京朝阳医院);李晓光 (北京医院);李晓松 (中国人民解放军总医院);李 雁 (北京清华长庚医院);李浙民 (北京大学肿瘤医院);林国乐 (中国医学科学院北京协和医院);刘春玲 (新疆医科大学附属肿瘤医院);刘家云 (空军军医大学西京医院);刘 晶 (大连医科大学附属第一医院);马少华 (北京大学肿瘤医院);彭 正 (中国人民解放军总医院);钱红纲 (北京大学肿瘤医院);曲丽梅 (吉林大学第一医院);宋 健 (首都医科大学附属北京友谊医院);孙 刚 (新疆医科大学附属肿瘤医院);王桂华 (华中科技大学同济医学院附属同济医院);王建六 (北京大学人民医院);王 亮 (大连医科大学附属第一医院);王 殊 (北京大学人民医院);王向东 (复旦大学附属中山医院);王学菊 (吉林大学中日联谊医院);武爱文 (北京大学肿瘤医院);张 梅 (安徽医科大学第一附属医院);张 卫 (天津医科大学第二医院);张 毅 (首都医科大学宣武医院);张志红 (安徽省肿瘤医院);赵 鹏 (天津市肿瘤医院);赵 翌 (大连医科大学附属第一医院);周 雷 (中日友好医院)
利益冲突声明:本共识由专家组内部成员针对讨论得出,所有参与者均不存在利益冲突,共识专家组成员与生物医药企业之间也无利益关系。
附件一:
注:a、环磷酰胺药物经体内代谢后实际发挥杀伤作用的是磷酰胺氮芥,因此该药物检测采用磷酰胺氮芥进行;b、异环磷酰胺药物经体内代谢后实际发挥杀伤作用的是帕利伐米,因此该药物检测采用帕利伐米进行;c、替吉奥、卡培他滨药物经体内代谢后实际发挥杀伤作用的为氟尿嘧啶,因此这两个药物的检测采用氟尿嘧啶进行;d、伊立替康经体内代谢后实际发挥杀伤作用的为SN-38,因此伊立替康检测采用SN-38进行。


附件二:


来源:生物医学与临床转化
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设