
蛋白质提取的原理是通过细胞破碎和分离蛋白质与其他细胞成分的方法,从而得到纯净的蛋白质。提取蛋白质是利用蛋白质的物理和化学性质进行分离和提取。蛋白质的物理性质包括分子量、电荷、溶解性等,化学性质包括氨基酸序列、亲水性、亲油性等。在细胞破碎法中,机械或化学方法破坏细胞膜,释放细胞内的蛋白质。在溶解法中,蛋白质溶解在缓冲液中,然后通过离心等方法分离蛋白质。
一、机械法裂解
很多情况下,微生物分泌蛋白质到培养基中,提取分离蛋白质就比较容易, 而对于细胞内蛋白质(比如酵母产生的葡萄糖-6-磷酸脱氢酶,黑曲霉产生的过氧化氢酶及葡萄糖氧化酶等),则需要采用机械方法或非机械方法对细胞进行有效的破碎。在实验室内已经有不少破碎细胞的方法,常用的机械方法包括超声波法、高压匀浆法、高速珠磨法等。
选择细胞的破碎方法要考虑破碎的目的和破碎对象的类型。如果为了定量获得细胞内蛋白质以进一步研究,破碎收率就很重要。细胞的类型、大小、形态、生长条件、细胞壁结构及环境温度、pH等因素都会造成细胞对不同破碎方法的敏感度也不同。可以根据实验及以往的经验来选择破碎方法,但要注意破碎不能影响到目的蛋白产物的活性,在细胞的破碎过程中尽量避免将产物暴露在不利的条件下。破碎过程中,常常产生比较多的热量,需要预先冷却样品(最好到4℃),在破碎过程中,应尽可能保持低温。另外,一旦细胞被破碎,就失去了代谢调节机制的控制,目的蛋白就会受蛋白酶的作用,因此需要迅速提取目的蛋白,或加入抑制剂,或降温以减小蛋白酶的作用。
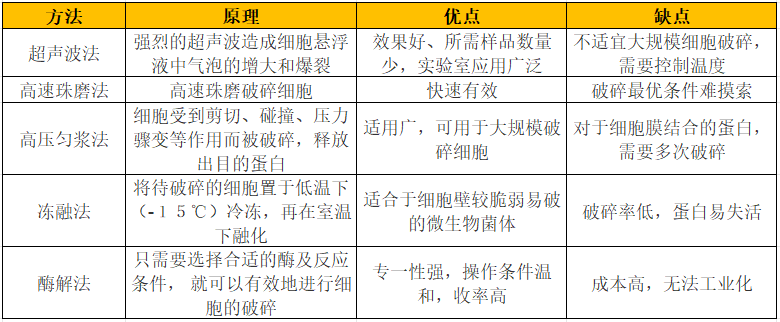
几种主要的细胞裂解方法的比较
二、化学法和酶法裂解
一些细菌裂解试剂中的活性成分是非离子去污剂或兼性离子去污剂, 这些试剂的功能是裂解细胞膜和细胞壁结构,削弱细胞的结构以便于通过渗透冲击、冻融、噬菌体溶菌酶或鸡卵白溶菌酶的酶解裂解细胞。除了极少数个例以外,革兰氏阳性菌通过溶菌酶单独处理就能够轻易裂解 。革兰氏阴性菌很难仅通过溶菌酶单独作用裂解,因为其外侧磷脂双分子层必须首先经过可渗透化处理 以暴露出其肽聚糖,细胞壁才能被酶降解。Tris 缓冲液中添加的 EDTA 能够使双分子层中大约 50% 的多聚阴离子脂多糖 暴露出来。
酵母比细菌更加难以裂解。它们致密而复杂的细胞壁占细胞干重的 25%。典型的成分是通过共价键、二硫键、氢键和疏水作用力相互交联的葡聚糖类、纤维素、甘露糖蛋白和壳多糖。为了较为高效地裂解细胞, 酵母菌应该在对数生长晚期和稳定生长早期收集,因为进入稳定生长期时间越长的酵母菌的细胞壁越厚,而且出芽酵母菌的细胞壁上也会出现密集的芽痕或芽体。可以在裂解试剂之中添加蛋白酶抑制剂, 也可以采用蛋白酶缺陷的菌株来表达蛋白质。
相比较机械法和化学法而言,酶法处理微生物细胞使之裂解并降低裂解物的黏度有几个显著的优点: 水解酶对目标细胞的细胞壁成分具有高度特异性, 它们作用温和,不产生剪切力; 不会导致高温或氧化等作用的破坏; 操作过程中不需要特殊的专用器械。酶法处理细胞、提取蛋白质可以与机械裂解法相结合来提高目标蛋白质释放的选择性,提高提取物的产量和获取速率,减小对产品的损伤,降低黏度以利于下游操作。Zymolase 和葡聚糖酶类溶细胞酶 (lyticaseglucanase) 是对于酵母菌细胞裂解及酵母原生质体的获得方面非常有用的酶类。
三、微生物蛋白质提取
3.1从菌液中提取总蛋白
1、配制裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
3.2从Trizol裂解液中分离总蛋白
1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。每1ml Trizol加入2ml洗液,室温放置20min, 2-8℃下7500g离心5min,弃上清,重复洗涤2次。最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g离心10min去除不溶物。
6、替代方案:将3中的酚醇上清液移至小分子量透析袋中,在2-8℃的1% SDS溶液中透析3次,1000g离心10min去除沉淀,上清可直接用于蛋白实验。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设