
在刚过去的3月,国家药品监督管理局有关医疗器械的公告及法规文件可谓密集发布,其在引发市场热度的同时,也在刺激着业界的神经。
从热度来看,“医疗器械临床试验审批程序调整”、“无菌和植入性医疗器械监督检查”以及“93项行业标准制修订项目计划”三大重磅消息,无疑炸开了市场。而从时间节点来看,这三大公告或法规的发布,前后不过12天。
在回顾、总结2019年3月份医疗器械行业政策动向的基础上,我们重点复盘了以上三大重磅政策,并汇总业界主要观点,或附简要点评。
医疗器械临床试验进入默许制时代
4月1日,国家药品监督管理局发布《关于调整医疗器械临床试验审批程序的公告》,表示对医疗器械临床试验审批作出调整,进一步优化临床试验审批程序。
《公告》指出,申请人在提出临床试验审批申请前,可以根据《关于需审批的医疗器械临床试验申请沟通交流有关事项的通告》(国家食品药品监督管理总局通告2017年第184号)与国家药品监督管理局医疗器械技术审评中心进行沟通。 自临床试验审批申请受理并缴费之日起60个工作日内,申请人在预留联系方式、邮寄地址有效的前提下,未收到器审中心意见(包括专家咨询会议通知和补充资料通知)的,可以开展临床试验。
对于同意开展临床试验的,器审中心将受理号、申请人名称和住所、试验用医疗器械名称、型号规格、结构及组成在器审中心网站公布,并将审查结果通过器审中心网站告知申请人,不再发放临床试验批件。
其他关于医疗器械临床试验审批要求,按照《医疗器械注册管理办法》等相关规定执行。本审批程序自发布之日起施行。
点评
《公告》一出台,业界媒体纷纷称此举 “标志着我国医疗器械临床试验与国际接轨,医疗器械临床试验进入默许制时代”。
其实,在2018年底举行的全国市场监管工作会议上,就有消息透漏,“2019年将优化医疗器械审评审批,加快创新医疗器械、临床急需医疗器械审批上市”。
到3月28日,在北京召开的医疗器械创新发展与审评审批改革座谈会上,国家药监局又听取了企业意见和建议,研究进一步鼓励医疗器械创新发展工作思路。
普遍观点认为,此次医疗器械产品临床试验审批再精简,可使企业节省大量产品研发成本,同时时间成本也将大大降低,从而加速产品上市。此外, 60天的默认期使得项目的可预见性极强,再加上项目预期投资回报率的提高,国产医疗器械企业的积极性也因此大大提高,这将有利于行业的良性发展,以及产业换代升级。
当前,我国医疗器械市场已初具规模,行业发展的“黄金十年”或将至。在国产化进程加快、产品多元化、市场集中化等行业背景下, 医疗器械临床试验审批程序的变革,也被认为是与“医疗器械注册人制度”配套的得力措施。 尤其对于已试点注册人制度的地区来说,创新医疗器械产品上市加速将更加明显。
医械93项行业标准制将修订
3月20日,国家药品监督管理局发布《关于印发2019年医疗器械行业标准制修订项目计划的通知》(药监综械[2019]23号)。
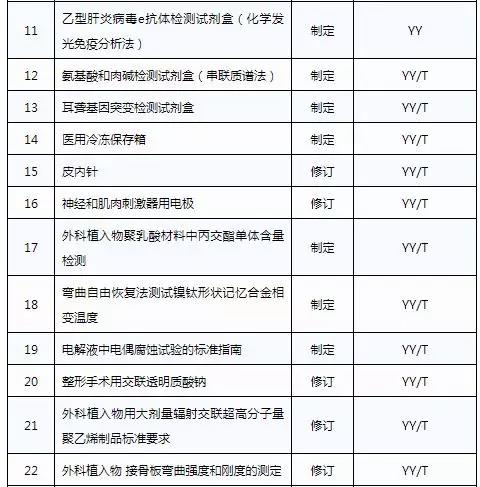
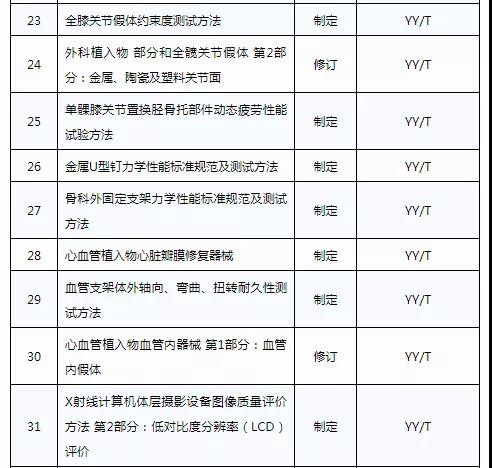
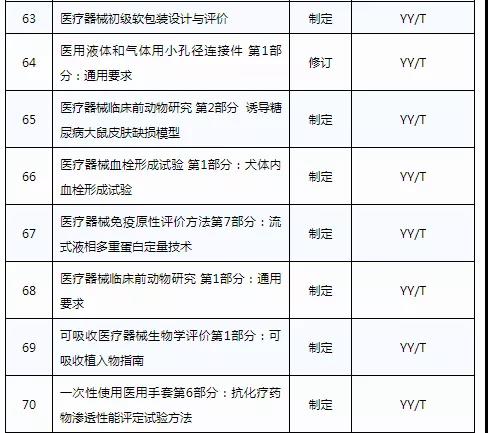
此前,国家药品监督管理局组织开展了2019年医疗器械行业标准制修订项目遴选工作。经公开征求意见和组织专家论证,此次《通知》确定了2019年93项医疗器械行业标准制修订计划项目,包括括听诊器、皮内针、医用诊断X射线机通用技术条件等,具体项目如下:




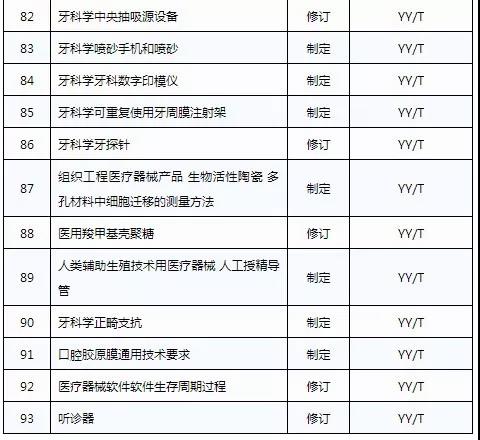
点评
近年来,我国医疗器械标准体系不断完善,对应监管也持续加强。
对于此次公示的93项医疗器械行业标准制修订计划项目,国家药监局器械注册司相关工作人员曾表示,“对于监管急需、基础通用、高风险产品标准和战略新兴产业等相关领域标准优先立项”。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设