
各有关单位:
为贯彻实施《医疗器械分类目录》(国家食品药品监督管理总局2017年第104号公告)(以下简称新《分类目录》),加强北京市医疗器械分类管理,进一步明确医疗器械产品分类有关工作的程序和要求,根据《医疗器械监督管理条例》(国务院令第650号)、《食品药品监管总局办公厅关于规范医疗器械产品分类有关工作的通知》(食药监办械管〔2017〕127号)和《国家食品药品监督管理总局关于实施<医疗器械分类目录>有关事项的通告》(2017年第143号通告)等相关规定,现将有关事项通知如下:
一、自2018年8月1日起,申请人应当按照新《分类目录》备案或提出注册申请,办理生产经营许可或备案申请。
二、新《分类目录》不包括体外诊断试剂,注册申请人应当按照《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《体外诊断试剂注册管理办法修正案》(国家食品药品监督管理总局令第30号)、《6840 体外诊断试剂分类子目录(2013版)》及后续发布的分类界定文件中有关体外诊断试剂的分类界定产品分类,提出体外诊断试剂备案或注册申请。
三、《关于发布第一类医疗器械产品目录的通告》(国家食品药品监督管理总局通告2014年第8号)、《食品药品监管总局办公厅关于实施第一类医疗器械备案有关事项的通知》(食药监办械管〔2014〕174号)和2014年5月30日以后发布的医疗器械分类界定文件中有关第一类医疗器械产品的分类界定意见继续有效。自2018年8月1日起,上述文件规定的产品管理类别与新《分类目录》不一致的,以新《分类目录》的产品管理类别为准。
四、对于新研制的尚未列入新《分类目录》或分类界定通知等文件的医疗器械,按照《医疗器械监督管理条例》第十六条规定申请类别确认的,申请人应当通过国家药品监督管理局医疗器械标准管理中心(以下简称标管中心)分类界定信息系统提出分类界定申请,并将纸质版资料寄送至北京市医疗器械技术审评中心,按照北京市医疗器械分类界定申报要求(附件1)办理。
五、我局负责对申请人提出的产品分类界定申请进行审查,经综合判定确定类别或提出预分类界定意见。对经审查可以确定为新《分类目录》等文件中产品的,直接在分类界定信息系统告知申请人产品类别;对经审查认为属于新研制尚未列入新《分类目录》等文件中的医疗器械的,通过分类界定信息系统将相关资料提交至标管中心,并将纸质版资料寄送至标管中心。
六、在技术审评中发现产品未列入新《分类目录》等文件中,或者未经分类界定信息系统告知分类界定结果的,北京市医疗器械技术审评中心应当按照《医疗器械分类规则》、《体外诊断试剂注册管理办法》等,结合技术审评判定产品类别,对于无法确定类别的,应将产品分类有关情况上报北京市食品药品监督管理局医疗器械注册和监管处(以下简称市局器械监管处),按照北京市医疗器械分类界定申报要求办理。
七、对于日常监管、稽查、投诉举报中涉及产品类别确认的,由市局器械监管处根据实际情况作出判定。必要时,市局器械监管处可向国家药品监督管理局提出分类界定请示,并提供用于支持分类的相应详细资料及预分类界定意见。
八、申请北京市创新医疗器械审批的产品分类,按照北京市医疗器械分类界定申报要求办理。
九、2018年8月1日前申请人已完成第一类医疗器械产品备案的,其备案凭证继续有效。新《分类目录》涉及产品类别由一类调整为高类别的,备案人应当按照改变后的类别向食品药品监督管理部门申请注册,应于2019年8月31日前完成注册并取得医疗器械注册证书。自2019年9月1日起,对于未取得分类调整后医疗器械注册证书而进行生产的企业,食品药品监督管理部门应按照《医疗器械监督管理条例》(国务院令第650号)有关规定进行处罚。
十、新《分类目录》实施后,对于产品类别发生变化的医疗器械,申请人应按照北京市医疗器械管理类别变化产品目录(附件2)及《国家食品药品监督管理总局关于实施<医疗器械分类目录>有关事项的通告》(2017年第143号通告)要求进行备案或注册。涉及产品管理类别由高类别调整为低类别的,注册人应当在医疗器械注册证有效期届满6个月前,按照改变后的类别向食品药品监督管理部门申请延续注册或者办理备案。涉及产品管理类别由低类别调整为高类别的,注册人应当按照改变后的类别向食品药品监督管理部门申请注册。在原医疗器械注册证有效期内提出注册申请的,如在开展产品类别转换工作期间注册证到期,注册人可向原审批部门提出原医疗器械注册证延期申请,予以延期的,原则上原医疗器械注册证有效期不得超过2019年8月31日。
自2019年9月1日起,对于未取得分类调整后医疗器械注册证书而进行生产的企业,食品药品监督管理部门应按照《医疗器械监督管理条例》(国务院令第650号)有关规定进行处罚。
十一、自2018年8月1日起,持按照新《分类目录》核发的医疗器械注册证申请医疗器械生产许可的,各区局、直属分局应依据医疗器械注册证按照新《分类目录》填写《医疗器械生产许可证》的生产范围和医疗器械生产产品登记表,其中生产范围应填写到一级产品类别。
自2018年8月1日起,持按照新《分类目录》核发的医疗器械注册证申请变更《医疗器械生产许可证》生产范围或增加生产产品的,各区局、直属分局应当依据医疗器械注册证将《医疗器械生产许可证》的生产范围和医疗器械生产产品登记表分成原《分类目录》分类编码区和新《分类目录》分类编码区,并明确标识,分别注明产品生产范围和产品信息。其中,按照新《分类目录》填写的生产范围应填写到一级产品类别。新旧版本分类编码产品生产范围不得混编,待全部产品均为新版产品分类编码的注册证后,不再分区。
对于未经许可从事第二类、第三类医疗器械生产活动的,食品药品监督管理部门应按照《医疗器械监督管理条例》(国务院令第650号)有关规定进行处罚。
十二、自2018年8月1日起,各区局、各直属分局发放的《医疗器械经营许可证》和《第二类医疗器械经营备案凭证》,经营范围应当分成原《分类目录》分类编码区和新《分类目录》分类编码区,经营范围应根据企业实际经营的医疗器械产品注册证进行填写,经营范围填写到子目录类别。
对于未经许可从事第三类医疗器械经营活动的,食品药品监督管理部门应按照《医疗器械监督管理条例》(国务院令第650号)有关规定进行处罚。
我局将进一步开展新《分类目录》的宣贯实施工作,规范北京市医疗器械产品分类相关工作。各区局、各直属分局敦促辖区内涉及分类调整的企业按要求完成产品备案或注册。同时,市局将以优化营商环境为目标,进一步优化许可流程、缩短审批时限。
附件:
1.北京市医疗器械分类界定申报要求
2.北京市医疗器械管理类别变化产品目录
北京市食品药品监督管理局
2018年7月5日
附件1
北京市医疗器械分类界定申报要求
为规范北京市医疗器械分类界定申请,提高申报资料质量,依据《北京市食品药品监督管理局关于医疗器械分类工作有关事项的通知》,特制定本申报要求。
一、材料申请
申请人通过中国食品药品检定研究院网站进入“医疗器械标准管理研究所”二级网站的“医疗器械分类界定信息系统”页面(http://www.nicpbp.org.cn/biaogzx)进行网络注册,注册后填写《分类界定申请表》,并上传其他申请材料。申请人应将在线打印的《分类界定申请表》,连同其他申请材料(应与网络上传的资料完全相同)加盖申请人骑缝章,并将申请材料通过邮寄或现场方式提交至北京市医疗器械技术审评中心(以下简称市器审中心)。(地址:西城区水车胡同13号,电话:010-58549949)。具体需提交资料如下:
1.分类界定申请表。应有法定代表人或负责人签字并加盖公章,如未经工商局注册,应提供《企业名称预核准通知书》等其他证明性文件,并由拟定法定代表人在申请表签字并注明日期。
2.产品照片和/或产品结构图.
3.产品技术要求和编制说明。
4.使用说明。
5.属于新产品的相关资料(如有),应当包括:
(1)与已上市产品、分类目录或分类界定通知文件中相关产品的分析及对比,并说明符合新研制尚未列入分类目录产品的判定原则;
(2)核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述;
(3)产品的创新内容;
(4)信息或者专利检索机构出具的查新报告;
(5)其他相关证明材料。
6.所提交资料真实性的自我保证声明,并作出材料如有虚假承担法律责任的承诺。
7.其他与产品分类界定有关的材料。
8.申报资料时,不是法定代表人或负责人本人的,应当提交《授权委托书》。
二、申请材料要求
1.申请材料应真实、完整、清晰、整洁,逐份加盖企业公章,要求签字的须签字。
2.申请人填报的表格和编写的申请材料均应为A4规格纸张,政府及其他机构出具的文件原件按原尺寸提供。
3.凡申请材料应提交复印件的,复印件应清晰,并应在复印件上注明日期,加盖企业公章。
4.申请材料左页边距一般应大于20mm(用于档案装订)。
5.申请材料中同一项目的填写应当一致。
三、工作时限
医疗器械产品分类界定应自接收申请材料之日起10个工作日(不含接收、寄送期限)内完成类别确认工作,需要补充资料时间不计算在内。
市器审中心对申请材料齐全、符合形式审查要求的,应当于2个工作日内网上办理接收申请材料。
市器审中心自接收申请材料之日起7个工作日内,完成技术审查,对申请材料不符合审查标准需要修改的,提出相应的补充修改意见,填写《补充材料通知书》,并交予申请人,双方签字、注明日期(补充材料时间不计算在审查期限内)。对于修改补充材料后符合审查标准的,审查完毕后出具技术审查意见,填写《分类界定审批表》,将相关技术审查意见及申请材料提交至北京市食品药品监督管理局医疗器械注册和监管处(以下简称市局器械处)。
市局器械处自收到申请材料之日起3个工作日内完成分类界定的审定工作。对分类界定审查可以确定产品类别的,直接在分类界定信息系统告知申请人分类界定结果;对分类界定审查不能确定类别的,应确认预分类意见,并于2个工作日内将相关材料寄送至国家药品监督管理局医疗器械标准管理中心。
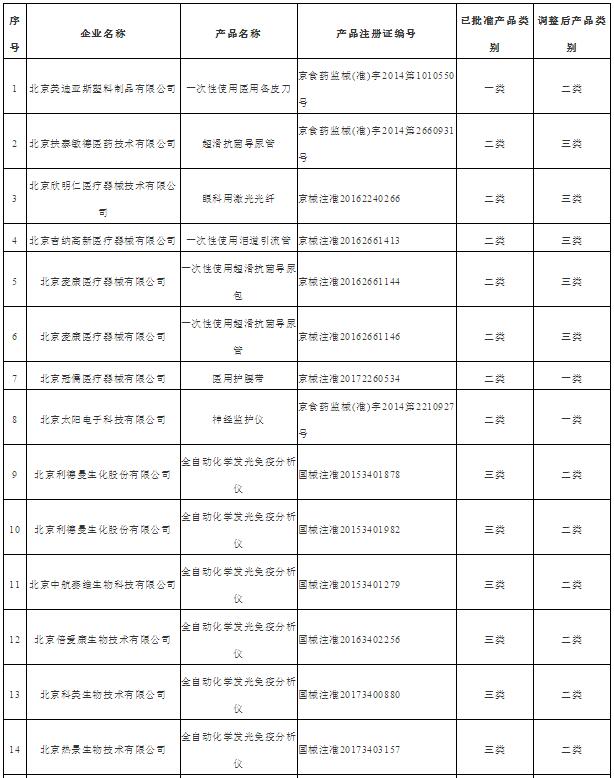
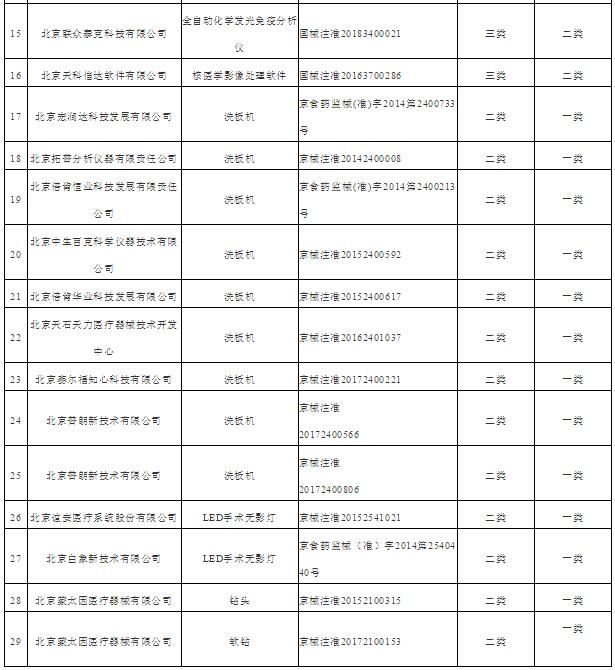
附件2
北京市医疗器械管理类别变化产品目录
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设