
按照北京市食品药品监督管理总局《关于组织开展医疗器械临床试验监督抽查工作的通告》(2016年第9号),2016年10月我局组织开展了第一批医疗器械临床试验监督抽查,检查发现6个医疗器械注册申请项目的临床试验存在真实性问题。现将有关情况公告如下:
一、检查结果
(一)德迈基生物技术(北京)有限公司的5个体外诊断试剂产品(具体见下表):
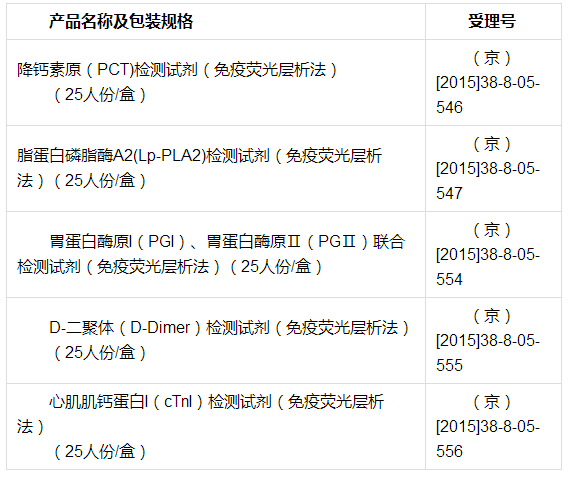
在对新乡医学院第三附属医院开展的上表中5个产品临床试验检查中发现:
1.病例未按照统计学原理进行选取,且抽查病例的干扰病例指标无法溯源;
2.无证据证明临床试验检测样本涵盖全血样本;
3.抽查的病例信息无法在院内LIS系统中追溯。
(二)北京中瑞华夏医疗科技有限责任公司的中医经络检测仪(规格型号为:ZR0301-JL,受理号为(京)[2015]38-8-01-191)
合同及临床试验报告等资料显示:北京宗古技术服务有限公司作为该公司的临床试验申办代理机构在中国人民解放军第二五一医院(以下简称二五一医院)开展临床试验。但现场检查中,二五一医院否认其承接了该公司中医经络检测仪的临床试验项目。
二、处理决定
(一)根据《医疗器械注册管理办法》第三十九条规定及《体外诊断试剂注册管理办法》第四十九条规定,对德迈基生物技术(北京)有限公司降钙素原(PCT)检测试剂(免疫荧光层析法)【包装规格为25人份/盒,受理号为(京)[2015]38-8-05-546)】、脂蛋白磷脂酶A2(Lp-PLA2)检测试剂(免疫荧光层析法)【包装规格为25人份/盒,受理号为(京)[2015]38-8-05-547)】、胃蛋白酶原I(PGI)、胃蛋白酶原Ⅱ(PGⅡ)联合检测试剂(免疫荧光层析法)【包装规格为25人份/盒,受理号为(京)[2015]38-8-05-554)】、D-二聚体(D-Dimer)检测试剂(免疫荧光层析法)【包装规格为25人份/盒,受理号为(京)[2015]38-8-05-555)】、心肌肌钙蛋白I(cTnI)检测试剂(免疫荧光层析法)【包装规格为25人份/盒,受理号为(京)[2015]38-8-05- 556)】、北京中瑞华夏医疗科技有限责任公司的中医经络检测仪【规格型号为:ZR0301-JL,受理号为(京)[2015]38-8-01-191)】6个注册申请项目不予注册。
(二)根据《中华人民共和国行政许可法》第七十八条规定,对上述6个注册申请项目自不予注册之日起一年内不予再次受理。
三、其他事项
2017年,我局将继续组织开展医疗器械临床试验监督抽查。注册申请人对其在审的医疗器械注册申请项目应当认真自查,对存在问题的主动撤回。在我局公布下一批医疗器械临床试验监督抽查项目名单后,不再受理列入监督抽查范围的注册申请人自行撤回的申请。
特此公告。
北京市食品药品监督管理局
2016年12月30日
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设