
本指导原则旨在指导和规范尿液分析仪产品的技术审评工作,帮助审评人员增进对该类产品原理/机理、结构、性能、预期用途等方面内容的理解,方便审查人员在产品注册技术审评时把握基本的要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。此外,审评人员还需密切关注相关法规的变化,以确认申报产品是否符合法规要求。本指导原则中不包括行政审批要求,不作为法规强制执行。
一、适用范围
本指导原则适用于基于干化学原理对尿液分析试纸条进行分析的尿液分析仪,按《医疗器械分类目录》管理类别为Ⅱ类,类代号为6840-5的临床检验分析仪器,不包括湿式尿液分析仪。
二、技术审查要点
(一)产品名称要求
尿液分析仪的命名方式:

(二)产品的结构和组成
尿液分析仪一般由机械系统、光学系统、电路控制系统、分析处理软件、显示和打印系统组成。
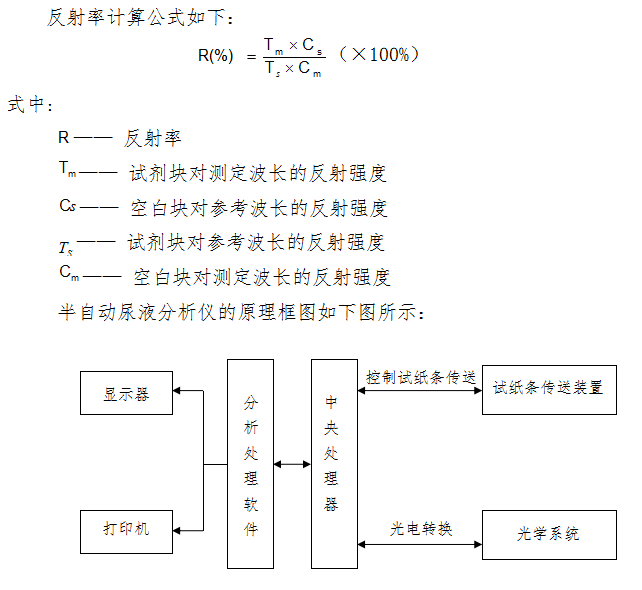
1. 半自动尿液分析仪
1.1 组成一般包括试纸条传送装置、光源、单色处理、光电转换、中央处理器、分析处理软件、显示和打印装置。
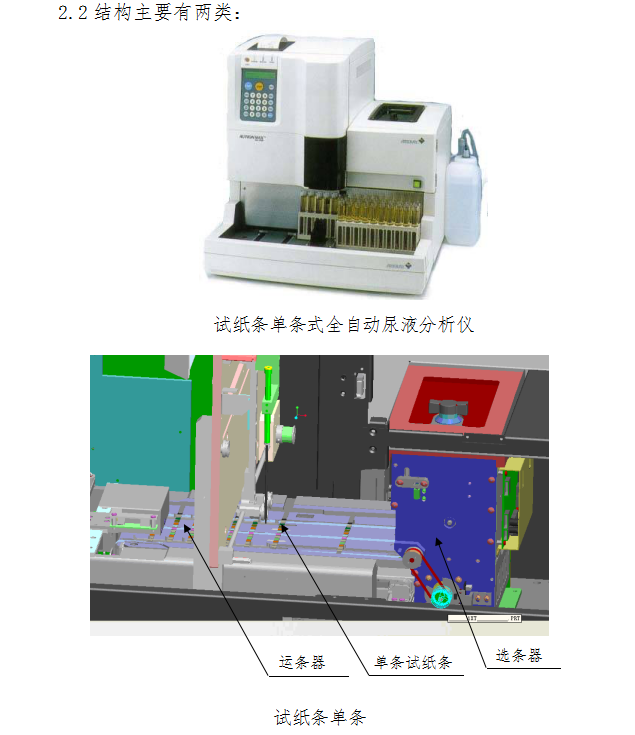
1.2结构主要有以下几类:试纸条传送带式、试纸条架式、皮带传送式和转盘式等,列举如下:

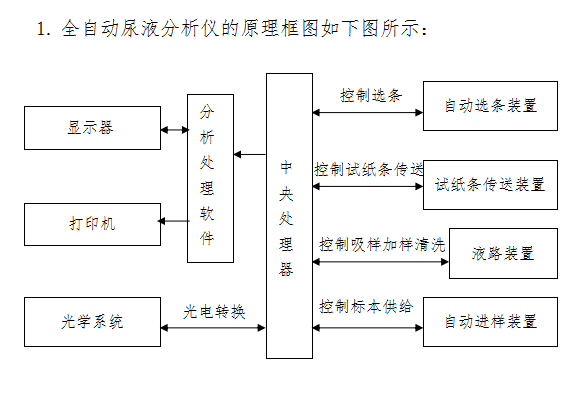
2. 全自动尿液分析仪
2.1组成一般包括自动进样装置、自动选条装置、试纸条传送装置、液路装置、光源、单色处理、光电转换、中央处理器、废料收集装置、分析处理软件、显示和打印装置。

(三)产品工作原理
尿液分析仪根据光电比色原理,通过试纸条上试剂区与尿液中生化成分反应产生的颜色变化,测定尿液中生化成分的含量。
当浸有尿样本的试纸条被放入试纸条架上后,仪器的传送装置将试纸条传送至检测器的正下方,试纸条上已产生化学反应的各试剂块被光源照射后,其反射光被检测器接收。试纸条中各试剂块与尿液中相应成分进行独立反应,显示不同的颜色,颜色的深浅与尿液中某种成分成比例关系。各试剂块反应后的颜色越深,吸收光量值越大,反射光量值越小,则反射率越小,反之,颜色越浅,吸收光量值越小,反射光量值越大,则反射率越大,也就是说颜色的深浅与尿液样本中的各种成分的浓度成正比。
试纸条中还有一个空白块,作为对尿液颜色及仪器变化产生的误差进行补偿。将测定的每种试剂区反射光的光量值与空白块的反射光量值进行比较,通过计算求出反射率,仪器根据反射率确定尿液中生化成分的含量。
(四)产品作用机理
因该产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(五)产品适用的相关标准
目前与尿液分析仪产品相关的常用标准如下:
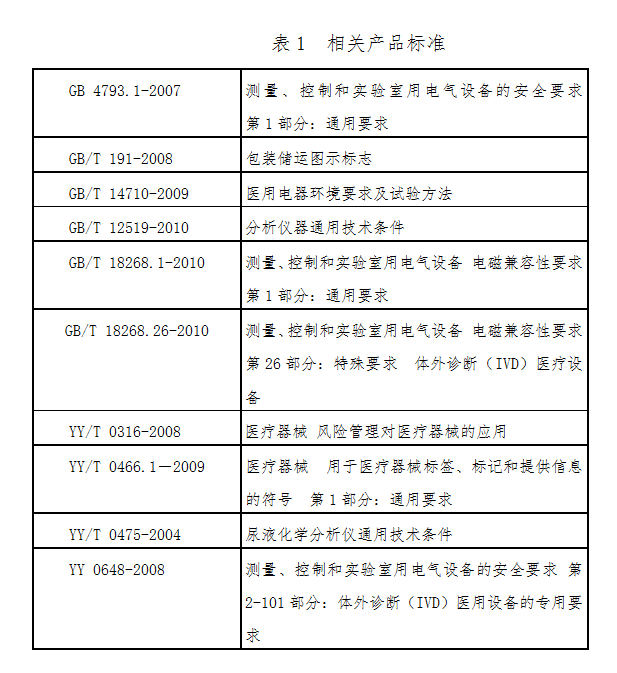
上述标准包括了注册产品标准中经常涉及到的标准。有的企业还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,是否为现行有效的版本。
其次对引用标准的采纳情况进行审查。即所引用标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
注意“规范性引用文件”和编制说明的区别,通常不宜直接引用或全面引用的标准不纳入规范性引用文件,而仅仅以参考文件在编制说明中出现。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
(六)产品的预期用途
与尿液分析试纸条配套使用,供医疗机构对人体尿液样本中生化成分进行半定量或定性检测,可检测项目主要包括尿8项、尿9项、尿10项、尿11项、尿12项、尿13项和尿14项等,为临床检验和诊断提供参考。目前可检测的项目有尿胆原、胆红素、酮体、潜血、蛋白质、亚硝酸盐、白细胞、萄葡糖、比重、酸碱度、维生素C、微白蛋白、肌酐、尿钙等,部分产品还包含尿液颜色检查和尿液浊度检查功能。
注:具体的检测项目应体现在产品的注册证和说明书中。
(七)产品的主要风险
尿液分析仪风险管理报告应符合YY/T 0316-2008《医疗器械 风险管理对医疗器械的应用》的有关要求,判断与产品有关的危害,估计和评价相关风险,控制这些风险并监视控制的有效性。主要的审查要点包括:
1.与产品有关的安全性特征判定,可参考YY/T 0316-2008的附录C、H。
2.危害、可预见的事件序列和危害处境判断,可参考YY/T 0316-2008附录E、I、H。
3.风险控制的方案与实施、综合剩余风险的可接受性评价及生产和生产后监视相关方法,可参考YY/T 0316-2008附录F、G、J、H。
尿液分析仪的初始可预见性危害主要存在于产品设计、生产和使用环节,风险分析至少包括表2内容,企业还应根据产品的自身特点确定其他危害。
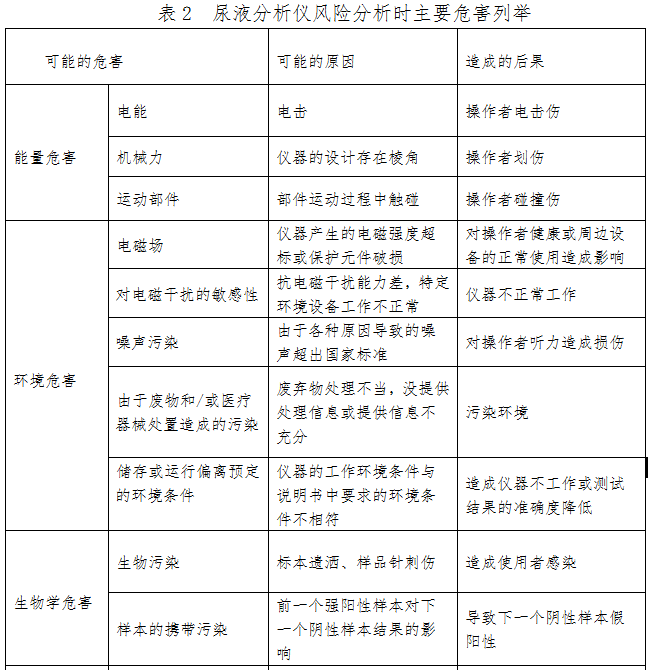
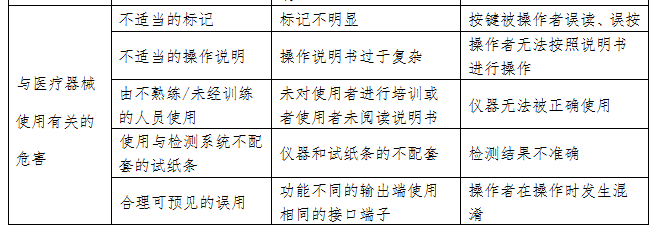
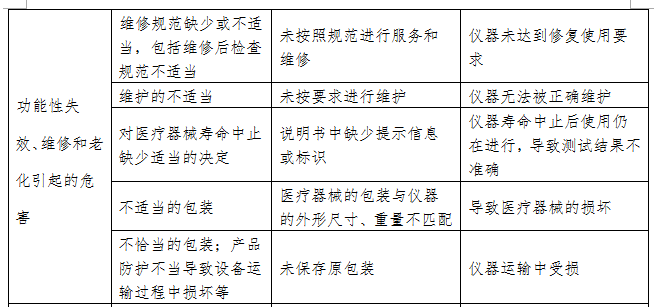

(八)产品的主要技术指标
产品标准的审查是产品主要技术性能指标审查中最重要的环节之一。
尿液分析仪主要技术性能指标可以分解为技术性能要求和安全要求两部分。其中有些技术性能要求和安全要求又是相关联的。
标准中规定的要求部分是否齐全,可以通过对是否具有以下主要内容进行审评。
1. 外观要求
分析仪外观应符合下列要求:
a)仪器外观整齐、清洁,表面涂、镀层无明显剥落、擦伤、露地及污垢;
b)铭牌及标志应清楚,所有紧固件不得松动,各种调节器件转动灵活,功能正常。
2.基本功能
分析仪至少应具有下列功能:
a)应能开机自检,识别并报告错误;
b)结果单位至少应有国际单位制;
c)应具有输入/输出装置;
d)应具备与管理系统相连接的检测信息输出端口;
e)断电后应能存储、记忆测试数据。
3.重复性
分析仪的重复性应符合下列要求之一:
a) 测试标准灰度条:分析仪对标准灰度条的反射比进行重复测试,测试结果的变异系数不超过1%。
注:
标准灰度条:是采用稳定性高、灰度均匀一致的物质制作而成的,并且与尿液分析试纸条形状、块间距大小相同,用来检测仪器的重复性和稳定性。
标准灰度条反射比在30%~80%之间。
b) 测试尿试纸条:分析仪对适配的尿试纸条重复测试结果的符合率不小于90%。
注:试纸条应从同一批号的20筒内条随机抽取一条。
4.分析仪与随机尿试纸条适配的准确度
尿试纸条所有检测项目各浓度的检测结果与相应参考溶液标示值相差同向不超过一个量级。阳性结果不得出现阴性,阴性结果不得出现阳性。
注:参考溶液的配制方法依据厂家提供的资料进行。
5.稳定性
分析仪的稳定性应符合下列要求之一:
a) 测试标准灰度条:分析仪开机8h内,分析仪对标准灰度条的反射比进行重复测试,测试结果的变异系数(CV)不超过1%。
b) 测试尿试纸条:分析仪开机8h内,分析仪对适配的尿试纸条重复测试结果的符合率不小于90%。
6.环境试验
应按照GB/T 14710-2009的要求进行。
7.电磁兼容性
应符合GB/T 18268.1-2010和 GB/T 18268.26-2010的要求,并参照国家食品药品监督管理部门相关文件执行。
8.电气安全
应符合GB4793.1-2007及YY 0648-2008中适用条款的要求。
(九)产品的检测要求
产品检测包括出厂检验和型式检验两部分。
1.出厂检验应包括性能要求和电气安全要求两部分。
性能要求至少应包括:重复性、分析仪与随机尿试纸条适配的准确度、稳定性。
电气安全要求至少应包括:可触及零部件的允许限值、插头连接设备的保护连接阻抗(如适用)、介电强度试验。
2.型式检验包括外观要求、基本功能、全部性能要求、环境实验要求、电气安全要求。
(十)产品的临床要求
根据《医疗器械注册管理办法》中《附件12 医疗器械注册临床试验资料分项规定》的要求,境内产品中国政府已批准同类产品在中国上市,提交同类产品的临床试验资料和对比说明;执行国家、行业标准的检验、诊断类医疗器械,不需要提供临床试验资料。
(十一)该类产品的不良事件历史记录
建议密切关注、收集相关不良事件的报道。
(十二)产品说明书、标签、包装标识
说明书、标签和包装标识应符合《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令第10号)的要求,同时还应符合GB 4793.1-2007和YY 0648-2008适用条款的要求,至少应包括以下内容:
1.说明书内容
分析仪应附有说明书,说明书至少应包括以下内容:
a)产品名称、商标/型号;
b)制造商名称、地址、联系电话;
c)仪器组成;
d)检测原理、方法、步骤;
e)工作环境条件;
f)主要技术指标;
g)参考值范围;
h)针对不同型号、不同批次的测试标准灰度条、测试尿试纸条和参考溶液的相关规定。
i)使用寿命;
j)贮存条件;
k)注意事项;
l)日常维护;
m)基本故障的排除;
n)废弃物处理;
o)说明书的出版及修订日期。
2.标签要求
分析仪应在明显位置固定耐腐标牌,并注明以下信息:
a) 产品名称、型号;
b) 电源参数;
c) 生产日期或序列号;
d) 制造商名称、地址。
3.标志要求
分析仪的外包装(箱)上至少应有下列标志:
a) 产品名称、商标/型号;
b) 制造商名称、地址、售后服务电话;
c) 执行标准号;
d)产品注册号;
e) 生产日期或序列号;
f) 质量;
g) 体积(长x宽x高);
h) GB/T 191-2008中规定的标志。
(十三)注册单元划分的原则
尿液分析仪产品的注册单元原则上以技术结构、性能指标和预期用途为划分依据,同时考虑以下两点:
1.对于光学系统相同的可归入同一注册单元。
2. 对相同的绝缘方式可归入同一注册单元。
(十四)同一注册单元中典型产品的确定原则和实例
能够代表注册单元其他产品安全性和有效性的典型产品。
功能的覆盖按最不利的原则确定,不能覆盖的差异性应作检测;
产品的结构、性能指标的覆盖:
涉及安全性、有效性关键件的一致性(关键件的规格类型等),不一致的应作检测。如:电源变压器(开关电源)、电机、过温保护装置、PC板、用作瞬态过压限制装置的电路、显示器、熔断器或熔断器座、设备外壳材料、高完善性元器件、电源开关以及光学系统有关部件等。
三、审查关注点
(一)注册产品标准的编制。注册产品标准中应明确产品的型号、结构组成等内容。注册产品标准应符合相关的国家标准、行业标准和有关法律、法规的规定,并按国家食品药品监督管理局发布的《医疗器械注册产品标准编写规范》的要求编制。
(二)产品的安全性是否符合安全要求。
(三)产品的主要性能指标确定的依据。
(四)产品的环境试验是否执行了GB/T 14710-2009的相关要求。
(五)说明书中对产品使用安全的提示是否明确。
(六)产品说明书中要写明产品工作原理、关键部件的使用寿命、可测试的具体项目、单位转换关系等。
(七)配套试纸条的说明、参考溶液配制资料及质控品的相关说明。
(八)关于报警:标准中的技术指标未包含报警功能,审查中应考虑仪器的报警功能,如:对需定期更换管路部件的仪器,除使用说明书中应指出定期更换的周期、方法外,仪器还应在大于规定使用时间时,仪器具有提示或报警功能。另外,当试纸未沾到样本或运动部件出现故障时,仪器应有提示或报警功能;仪器还应该具有自检功能,否则在临床使用中会产生风险。报警的设置情况可在技术报告中进行阐述。
尿液分析仪产品注册技术审查指导原则编制说明
一、编写目的
本指导原则旨在指导和规范尿液分析仪产品的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
由于尿液分析仪产品仍在不断发展,审查员仍需密切关注相关法规、标准及尿液分析仪产品技术的最新进展,关注审评产品实际结构组成、功能、预期用途等方面的个性特征,以保证产品审评符合现行法规安全、有效的要求。
二、编写依据
本指导原则主要依据《医疗器械监督管理条例》(国务院令第276号)、《医疗器械注册管理办法》(国家食品药品监督管理局令第16号)、《医疗器械临床试验规定》(国家药品监督管理局令5号)、《医疗器械说明书、标签和包装标识管理规定》(国家食品药品监督管理局令10号)、《医疗器械标准管理办法》(国家食品药品监督管理局令31号)、产品注册相关规范性文件及《YY/T 0475-2004尿液化学分析仪通用技术条件》的相关要求和有关公开出版文献资料并结合尿液分析仪产品的特点,制定本指导原则。
三、编写格式
本指导原则的编写主要遵从国家食品药品监督管理局关于《医疗器械产品注册技术审查指导原则编写格式要求》的具体要求编写的。
四、部分内容的编写说明
(一)产品技术指标执行《YY/T 0475-2004尿液化学分析仪通用技术条件》行业标准的要求。
(二)签于《YY/T 0475-2011干化学尿液分析仪》行业标准将于2013年6月1日正式实施,在该标准正式实施之日,其相应的适用条款应被引用。
1.新标准中修改了如下内容:
a)删除了原标准中3.4条重复性测试使用试纸条测试的相关内容;
b)删除原标准中3.6条稳定性测试使用试纸条测试的相关内容;
c)电源电压中增加了关于便携式设备使用直流电源的要求;
d)增加了术语“量级”;
e)增加了关于“携带污染”的要求。
2.新标准的内容如下:
2.1外观
a)仪器外观整齐、清洁,表面涂、镀层无明显剥落、擦伤及污垢;
b)铭牌及标志应清楚。
2.2重复性
分析仪反射率测试结果的变异系数(CV,%)≤1.0%。
2.3与适配尿液分析试纸条的准确度
检测结果与相应参考溶液标示值相差同向不超过一个量级,不得出现反向相差。阳性参考溶液不得出现阴性结果,阴性参考溶液不得出现阳性结果。
2.4稳定性
分析仪开机8小时内,反射率测试结果的变异系数(CV,%)≤1.0%。
2.5携带污染
检测除比重和pH外各测试项目最高浓度结果的阳性样本,随后检测阴性样本,阴性样本不得出现阳性。
2.6功能
分析仪至少应具有下列功能:
a)应能开机自检,识别并报告错误;
b)结果单位至少应有国际单位制;
c)应具备输出端口;
d)应能存储测试数据;
e)仪器应具有校正功能。
注:《YY/T 0475-2011干化学尿液分析仪》标准中环境试验、电磁兼容性和电气安全的要求与《YY/T 0475-2011尿液化学分析仪通用技术条件》标准的要求相同。
(三)此类产品的不良事件历史记录主要从国家食品药品监督管理局、吉林省食品药品监督管理局的不良事件数据库中查找,也征询了相关领域的临床专家,暂未发现不良事件记录,请密切关注不良事件相关报道。
(四)产品的主要风险参照YY/T 0316-2008进行编制,主要对产品进行了特征判定,并根据特征判定的结果进行了风险分析。
五、指导原则编写人员
本指导原则的编写成员由吉林省食品药品监督管理局医疗器械处产品注册技术审评人员、吉林省医疗器械检验所检验人员、吉林省医疗器械审评中心审评人员、专业厂家代表及临床专家、工程技术专家等共同组成,充分利用了各方面的信息和资源,综合考虑指导原则中各个方面的内容,尽量保证指导原则正确、全面、实用。
邮政编码:200052 电话:021-63800152 传真:021-63800151 京ICP备15010734号-10 技术:网至普网站建设