2019年医疗器械(体外诊断)政策法规汇总
更新时间:2020/1/3 15:16:25 浏览次数:2786时光如梭,白驹过隙,转眼便到了2020。这一年里,医疗器械(体外诊断)行业究竟发生了怎样的变化?让我们稍稍回顾一番:
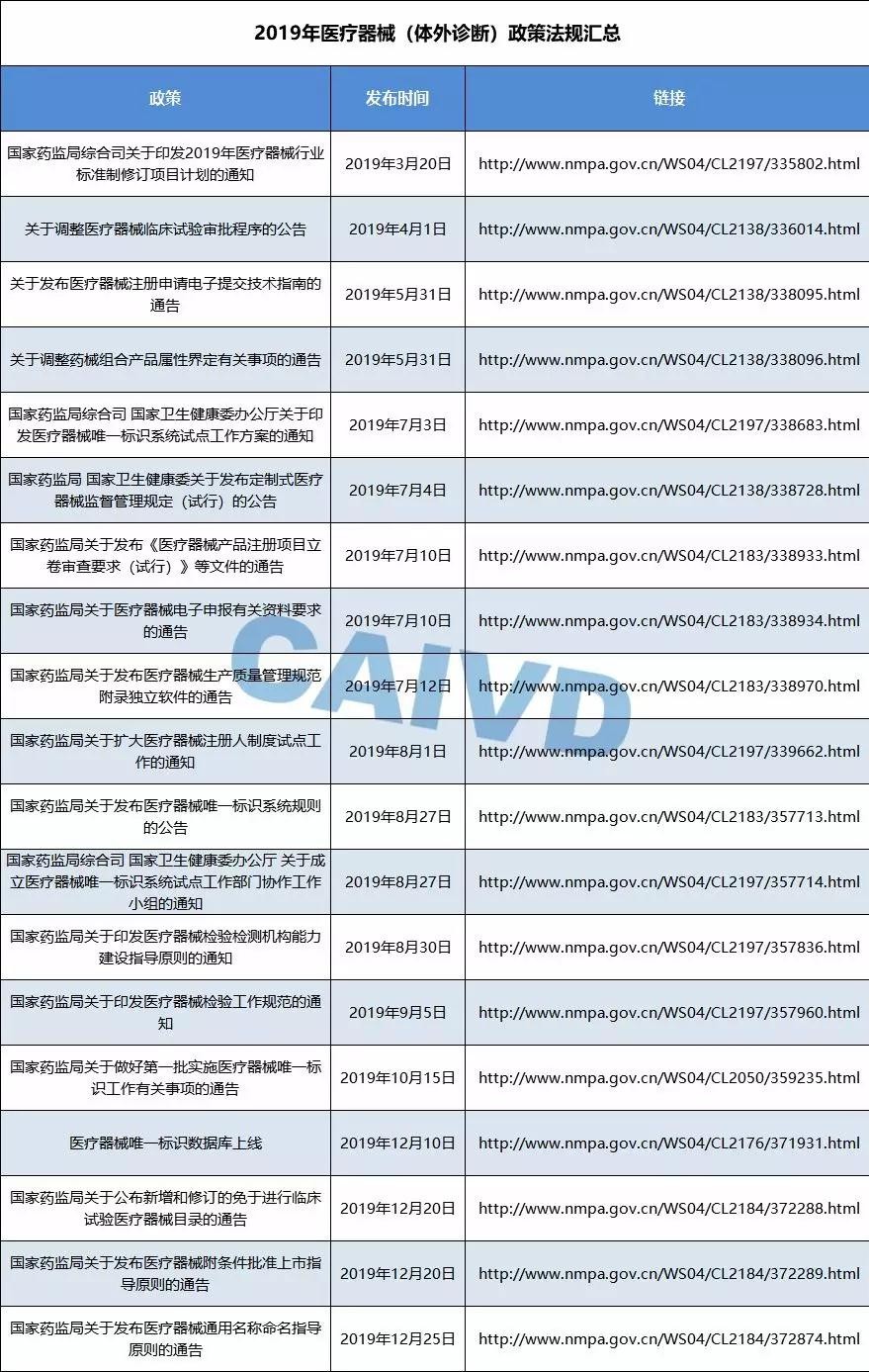
2019年05月31日,国家药监局发布关于实施医疗器械注册电子申报的公告。为实现医疗器械注册申请的电子申报,国家药品监督管理局组织开发了医疗器械注册电子申报信息化系统(eRPS)。
2019年6月24日,正式启用eRPS系统。
2019年07月03日,为加强医疗器械全生命周期管理,提升医疗器械监管和卫生管理效能,进一步保障公众用械安全,《医疗器械唯一标识系统试点工作方案》发布,2019年12月10日,医疗器械唯一标识数据库上线。至此医疗器械也有了自己的一张“身份证”。
2019年07月12日,国家药监局发布医疗器械生产质量管理规范附录独立软件的通告。加强了独立软件类医疗器械生产监管,规范了独立软件生产质量管理。
2019年08月01日,国家药监局发布《关于扩大医疗器械注册人制度试点工作的通知》,加快推进医疗器械产业创新发展,在前期上海、广东、天津自贸区开展医疗器械注册人制度试点工作的基础上,进一步扩大医疗器械注册人制度试点,为全面实施医疗器械注册人制度进一步积累经验。至此,北京、天津、河北、辽宁、黑龙江、上海、江苏、浙江、安徽、福建、山东、河南、湖北、湖南、广东、广西、海南、重庆、四川、云南、陕西等21个省、自治区、直辖市参加医疗器械注册人制度试点并已公布方案。
2019年12月20日,国家药监局公布新增和修订的免于进行临床试验医疗器械目录的通告。时至今日,免于进行临床试验医疗器械产品涵盖1003项,其中体外诊断仪器产品达54项;体外诊断试剂产品共416项。
2019年是灿烂的一年,值得回味。政策法规推动行业进步,为行业发展带来便利。审时度势,推陈出新,2019永远记忆,2020携手同行。
 扫描下载
扫描下载体外诊断头条APP
 扫描关注
扫描关注CAIVD官方微信
 扫描关注
扫描关注CAIVD官方视频号
 扫描关注
扫描关注CACLP官方微信
 扫描关注
扫描关注CACLP官方视频号
全国卫生产业企业管理协会实验医学分会
( 京ICP备15010734号-10 )



