【共同关注】重大突破!一滴血可测癌症!业界怎么看?
更新时间:2017/5/2 14:16:03 浏览次数:27621、重大突破!一滴血可测癌症,已被批准临床使用
有这样一串冷冰冰的数字:
2015年,我国新增429.2万癌症患者,癌症死亡病例达到281.4万,很多人因此谈癌色变。
显症状,往往到了晚期才被发现。
于是,一个世界性课题——如何及时发现癌症,一直困扰着国内外的医学界。二十多年来,罗永章和他的团队一直在寻找答案,并且有了历史性突破!
这支中国医疗团队发明的一款“照妖镜”,可让癌症早早现出原形,挽救成千万人的生命!
中国每分钟新增8位癌症患者
清华大学生命科学学院罗永章教授说,2015年咱们国家新增的癌症病例大约是430万,死亡的是280万,也就是平均每分钟新增的癌症患者已经超过8人。
罗永章,清华大学生命科学学院教授。4月22日,在这场癌症新型标志物的研讨会上,他一开始就抛出了一连串冷冰冰的癌症数字。
据世界卫生组织预测,2020年全球癌症新发病例将达到2000万,因癌症死亡1200万人。寻找到癌症治疗和监测的有效手段是全世界众多科学家为之努力的方向。可是在现实中,如何及时发现癌症一直困扰着国内外的医学界。
罗永章说,肿瘤为什么一旦被发现,多半都是中晚期,这是我问的第一个问题。第二个大家都知道,90%以上的恶性肿瘤最终死于转移,但是如果能早期发现的话,治愈率可以高达95%。
重大突破!一滴血可测癌症
早癌九成可治,晚癌九死一生。肿瘤具有隐秘性,早期的肿瘤虽然好治愈,可是由于没有明显症状,往往到了晚期才容易被人发现。而晚期的肿瘤已经转移、扩散,很难医治。罗永章在上世纪八十年代大学刚毕业时就痛苦地看到了这个事实。
罗永章说:大学毕业以后,我同班一个同学就被发现得了癌症,而且是胰腺癌,手术以后不到半年就去世了。所以在我这个同学去世以前,希望我能学与肿瘤相关的专业。
要好的同学因为癌症而去世,深深刺激了罗永章。在美留学期间,他毅然从本科的化学专业改成了生物学,从此,开始了与癌症斗争的事业。
1998年,一个偶然的契机,促使罗永章回国,并研发出抗癌新药恩度,让药价大幅下降。不过,肿瘤早发现的问题,还一直困扰着罗永章。医学界现有的用于检测癌症的肿瘤标志物,都存在不稳定的问题,难以及时发现潜在的危险。究竟如何才能找到一条及时发现肿瘤的快速通道?二十多年来,罗永章和他的团队一直在寻找答案。
事实上,早在1989年,学术界就发现了人体中的热休克蛋白90α可以成为肿瘤发现的标志物。二十多年以来,世界各国的研究团队已经围绕这个蛋白,发表了超过1万篇研究论文,并产生3位美国院士和3位欧洲院士,但迟迟没有研究成果转化为产品。
2009年,罗永章团队开始介入研究,并通过重组蛋白质大规模制备技术,人工制备出了结构稳定的热休克蛋白90α。这相当于他们可以自由“制造”这种蛋白。在此基础上,他们还自主研发出了一种专门检测热休克蛋白90α的试剂盒。患者只需取一滴血,即可用于癌症病情监测和治疗效果评价。
罗永章说:把人的血液拿过来,以后放在这个盒子里面,跟抗体相互作用,看颜色的变化,这样可以定量检测天然HSP90α的含量。
2013年,罗永章团队联合中国医学科学院肿瘤医院等八家医院,搜集了2036例入组样本,完成了世界上第一个将热休克蛋白90α作为肺癌标志物的临床试验。在全球首次证明了热休克蛋白90α,是一个全新的肿瘤标志物。目前,我国自主研发的Hsp90α定量检测试剂盒已通过临床试验验证,获得国家第三类也是最高类别的医疗器械证书,并通过欧盟认证,获准进入中国和欧盟市场。
罗永章团队的研究在国际医学界引起轰动,DNA双螺旋发现者、诺贝尔奖得主詹姆斯·沃森博士专门来信祝贺。于2009年在《美国科学院院刊》发表,引起国际同行的广泛关注和引用。国家食品药品监督管理总局很快将其批准用于肺癌患者的病情监测和疗效评价。这是人Hsp90α被发现24年来,全球第一个将其用于临床的产品。
在肺癌之后,罗永章团队在2016年完成了肝癌上的临床研究,在世界上首次证明,热休克蛋白90α可用于肝癌患者的检测,现已被国家食品药品监督管理总局批准在临床中使用。除了肝癌和肺癌的监测外,由于有了热休克蛋白90α检测技术,当一些癌症转移到肝部和肺部两个器官时,医生能够及时获得信息,从而做出最佳的治疗方案。
癌症“照妖镜”获国家许可,却遇推广门槛
罗永章团队研发出了可以检测热休克蛋白90α的试剂盒,而这个试剂盒只是一种实验室产品,要想让它服务千百万患者,必须实现它的产业化,这个过程也并不简单。
2008年,普罗吉公司与清华大学共同组建了抗肿瘤蛋白质药物国家工程实验室,这也是国家发改委在清华大学批准建立的第一个国家工程实验室。在公司的实验室里,研发中心负责人李米川给我们展示了已经量产出来的热休克蛋白90α试剂盒。使用试剂盒检测人体热休克蛋白90α,全程只需要3小时,没有太高的技术门槛。可是,试剂盒的标准化量产却并不容易。
烟台普罗吉生物科技发展有限公司总经理崔大伟说:在生物制药领域,其实最开始的实验室研究很多时候都会成功,但是一到真正量产的时候,也就是我们叫做放大的这个实验的时候,就很有可能会遇到困难。
2009年,崔大伟到烟台办起了热休克蛋白90α试剂盒工厂。要将实验室里的科研成果转化为产品,首当其冲就是技术放大难题。实验室的科研对热休克蛋白90α抗体需求量小,不需要让它保持太久的稳定性。而崔大伟要量产试剂盒,必须让热休克蛋白90α溶液有着足够的稳定期,才能保证产品有较长的销售期。为了让量产的热休克蛋白90α溶液稳定下来,崔大伟耗时一年,开发了一套针对热休克蛋白90α的保护溶液体系。这让他们可以把产品有效期做到一年以上。而国外最高水平只能维持6个月的稳定。
热休克蛋白90α试剂盒从实验室进入工厂,再从工厂走下了生产线,研发生产团队可谓是一路坎坷。不过,热休克蛋白90α是否真能成为癌症的照妖镜,最重要的还需要临床的检验。那么,热休克蛋白90α的检测效果究竟如何呢?
这位正在采血的中年人,是一名癌症患者。他在2014年被确诊为肺癌晚期。之后进行了手术并进行化疗,他急需一种有效的肿瘤检测手段,及时了解自己病情的变化。当他偶然了解了热休克蛋白90α检测技术后,便做了包括它在内的多种肿瘤检测。这一天,他来体检中心,检查自己的热休克蛋白90α值。
这位癌症患者说:到了9月份的时候又做了一次,这次距离手术已经有9个月了,这个时候其他的情况都还显示是正常的。像CE1、Ca125肿瘤标志物,这些都是正常的,但是90α就到了100多、120几的样子。这个不正常。
除了热休克蛋白90α的数值异常,别的肿瘤标志物都显示正常,再加上没有别的反应,使这位患者并未引起太大的重视。但令他没想到的是,到了2015年,其他的肿瘤标志物指标也不正常了。
癌症患者:一直到了2015年,这个时候CT已经明显出问题了,体感也能够感觉到不好的感觉。后来,这个时候开始吃药。当时是在CT和其他几个提前半年,90a反映出来的,如果我当时有这方面的知识,应该警觉,早一点干预。
眼下,经过积极治疗,这位患者的病情已经得到控制。运用多种手段检测身体的变化,成为了他的必修课。
癌症患者:到了2016年6月份,90a又降到60几,因为CT显示也不错。
临床数据表明,在肺癌中,传统的肿瘤标志物CEA灵敏度只有54%,符合率为66%;而热休克蛋白90α的灵敏度达到72%,符合率为75%,明显优于CEA。而在肝癌中,传统的标志物AFP灵敏度为53%,符合率为74%;热休克蛋白90α的灵敏度达到93%,符合率为92%。
2、读“清华滴血验癌”新闻有感:兼议临床应用的蛋白类肿瘤标志物

近期,有个标题为“清华教授发现全新肿瘤标志物研发试剂可测癌症”的新闻很火,科学网有多篇相关评论博文,其中至少有两篇还被编辑置顶推荐。我本打算对该新闻不做任何评论,无奈如鲠在喉,不吐不快,只好写此博文,谈谈自己的粗浅看法。
从中新社的这篇新闻的报道来看,清华罗永章教授的这个成果至少有三个亮点:1)“在国际上首次发现Hsp90α(热休克蛋白90α)为一个全新的肿瘤标志物“;2)“患者只需取一滴血液,通过试剂盒检测,即可用于病情监测和治疗效果的评价,为指导肿瘤个体化治疗提供辅助依据”;3)“自主研发的Hsp90α定量检测试剂盒已通过临床试验验证,获得了国家第三类(最高类别)医疗器械证书,并通过了欧盟认证,从此获准进入中国和欧盟市场“。如果都是真的,这个成果确实称得上是重大成果,尤其是能进入欧盟市场很不容易。本文先简单分析一下这三个亮点是否属实,或者准确。
首先看罗教授是否是在“国际上首次发现Hsp90α为一个全新的肿瘤标志物”。Hsp90 (heatshock protein 90),是一类分子伴侣蛋白,是热休克蛋白家族中的一类,90是指其分子量为90 kDa, Hsp90α是其中的一个亚型,这类蛋白的主要功能是辅助其它蛋白正确折叠,在蛋白质遇热时能稳定蛋白,这也是该类蛋白名称的由来,Hsp90可以帮助蛋白降解,还可以稳定一些肿瘤生长所需的蛋白,因此,抑制Hsp90,就可以这些肿瘤生长所需的蛋白,从而达到抗癌的作用,这也是Hsp90抑制剂抗癌作用的大致机理。目前,至少有几十个正在进行或已经结束的临床试验来检验Hsp90的多种抑制剂抗癌疗效,一个III期临床试验已经结束,该试验药物有望不久被美国FDA批准上市。在这些药试验过程中,检测Hsp90α是证明其抑制剂的有效方法,因此,至少在10多年前,Hsp90α作为一种潜在的肿瘤生物标志物就有报道,检测Hsp90α的试剂盒也早就应用于临床前的动物试验。而罗教授在2009年才开始第一篇有关Hsp90α的论文,因此,目前没有任何证据表明罗教授在“国际上首次发现Hsp90α为一个全新的肿瘤标志物”,简单文献检索表明:在国际有影响的期刊上,已经有多篇有关Hsp90α是肿瘤标志物的综述文献,作者都不是罗教授,显示他在这个领域既不是首创者,也很可能不是最有影响的学者。
该成果的另一亮点是“滴血验癌”,患者只需取一滴血液就可搞定。这个其实并没有什么神奇,能做到只需一滴血,主要原因有两点:第一点:试验方法灵敏度高,尽管该报道并没有具体报道该试剂盒的作用原理,但是几乎可以肯定是基于ELISA技术(即:酶联免疫吸附),相信搞生物的网友大多对该技术不陌生,ELISA技术基于结合强度和特异性很高的抗原-抗体反应,即使是很少量的抗原,也可以通过该技术检测出来。第二点:Hsp90α的含量高,Hsp90在没有受到热压力的细胞中,占蛋白总量的高达1-2%,而当细胞受热时,该数字更可以升至4-6%。因此,就技术本身而言,ELISA技术作为一种成熟而广泛应用的技术,可以说本身没有多大的难度,目前,应用于非临床试验研究的检测Hsp90α的试剂盒,国际上有不少公司生产出售。
所以罗教授的成果的亮点就剩一个了,即通过了临床试验验证。该检测方法能在中国获得CFDA的批准,似乎并不能证明罗教授的技术比国外同行的更胜一筹,因为中国的临床试验,一直为国内、国际同行所诟病,其靠谱程度,估计在医院工作的网友更清楚。如果该技术在欧洲通过临床验证,并被欧盟EMA批注,上述的怀疑那简直就是污蔑了。然而,无论是EMA官方网站还是google网上检索,都没有发现罗教授的这个技术“通过了欧盟认证”、“获准进入中国和欧盟市场”。如果有网友发现相关报道或其它证据证明该检测技术已被欧盟认证,欢迎留言、评论。本文无意贬低罗教授的成果,只是觉得任何成果都不应该被过度评价和放大,而应该实事求是的评价。
下面就谈谈自己所粗略了解的美国FDA批准的现在用于临床的蛋白肿瘤标志物。肿瘤标志物是生物标志物的一类,由于肿瘤/癌症的研究最为广泛、深入,临床需求也最大等多种原因,肿瘤标志物是生物标志物的研究最多的。生物标志物的定义多种多样,最为权威的大概要数NIH在1998年的定义:"a characteristic that is objectively measured and evaluated as an indicator of normal biologic processes, pathogenic processes, or pharmacologic responses to a therapeutic intervention." 生物标志物根据其检测目的和功用,可至少分为如下10类(恕不能一一翻译)。从报道看,罗教授的检测Hsp90α试剂盒貌似属于prognostic biomarkers(预后生物标志物)
Translation biomarkers are used in both a preclinical (i.e. animal models) and clinical setting
Early detection biomarkers are used to identify the earliest stages of disease onset
Diagnostic biomarkers are used to identify the presence or absence of a specificdisease state
Staging biomarkers are used to distinguish between different stages of a chronic disorder
Prognostic biomarkers are used to determine patient survival probability
Disease biomarkers are related to a clinical outcome or measure of disease
Predictive or efficacy biomarkers are used to predict the efficacy of a specific drug therapy
Target biomarkers are used to determine the interaction of a drug or small molecule with its target
Mechanism biomarkers are used to report on the downstream effects of a drug
Toxicity biomarkers are used to determine the toxicological effects of drugs on an in vitro or in vivo system
Surrogate biomarkers are regarded as valid substitutes for measuring clinical outcomes
生物标志物可以是蛋白质,也可以是DNA, RNA等,下面主要谈谈蛋白类生物标志物。迄今为止,被美国FDA批准的现在用于临床的蛋白肿瘤标志物只有23种/类(参见下表,个别方法含有多种蛋白标志物)。而在Pubmed上文献检索显示,用“biomarker”(生物标志物)做关键词,有63万篇文献,改用“cancer biomarker”(肿瘤生物标志物)则还有23万篇,即使该用“lung cancer biomarker”(肺癌生物标志物,罗教授的试剂盒就是用于肺癌的),仍有1.8万篇。这和只有区区23种临床应用的蛋白肿瘤标志物有很大反差,23万 VS. 23,正好相当于发表一万篇肿瘤生物标志物论文才有一种肿瘤标志物成功应用于临床,真正地“一将成名万骨枯”!这充分显示出生物标志物应用于临床并不是一件容易的事,尤其是在监管严格的美国,事实上,最近10年,平均1.5年才有一种新的肿瘤蛋白标志物检测技术被美国FDA批准。值得注意的是,这些蛋白肿瘤标志物绝大多数都是基于免疫反应来检测的(包括ELISA,免疫组化),但是这些标志物在被发现过程中,有些是采用基于质谱技术的蛋白质组学来最先确定的,比如同时检测5中肿瘤标志物的OVA1技术(表中第三种, FDA2009年批准),用于卵巢癌早期诊断,就是最初是采用SELDI质谱技术鉴定了,7种蛋白标志物,后来通过优化,采用了5种蛋白,并且由于多种原因,最终采用了ELISA技术。目前限制质谱技术在临床应用的原因有多种,如: 1)样品前处理时间过长,无法实现高通量;2)仪器本身价格昂贵且样品分析时间过长;3)重现性不够高;4)技术本身和仪器使用难度较大,最终数据解释不易等。
美国FDA批准的现在用于临床的蛋白肿瘤标志物
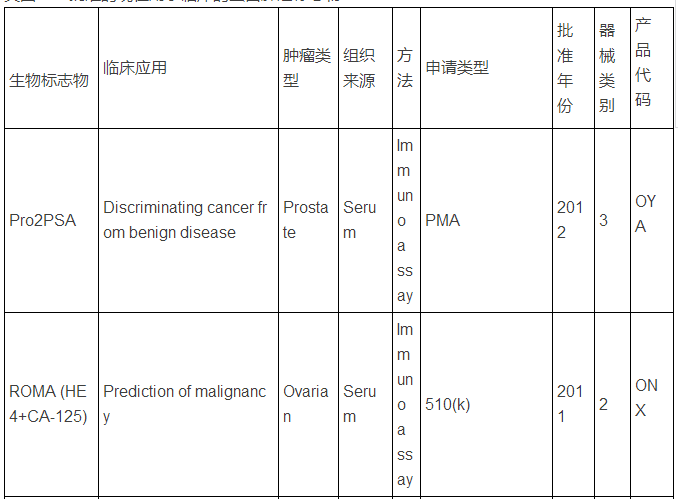
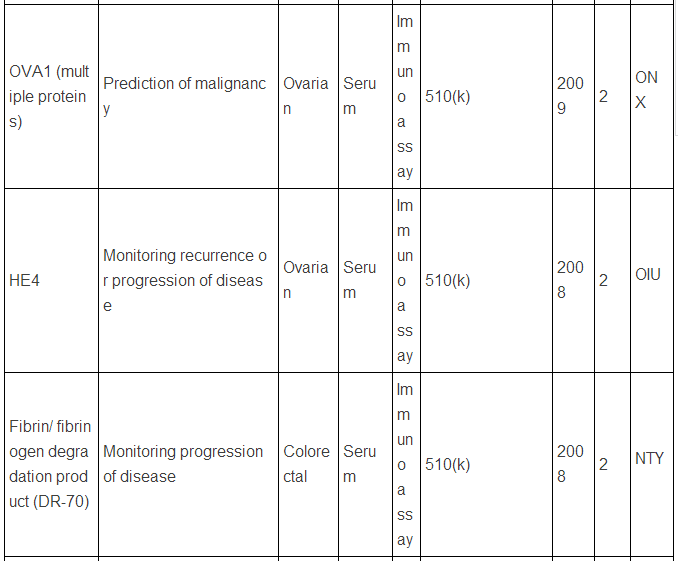


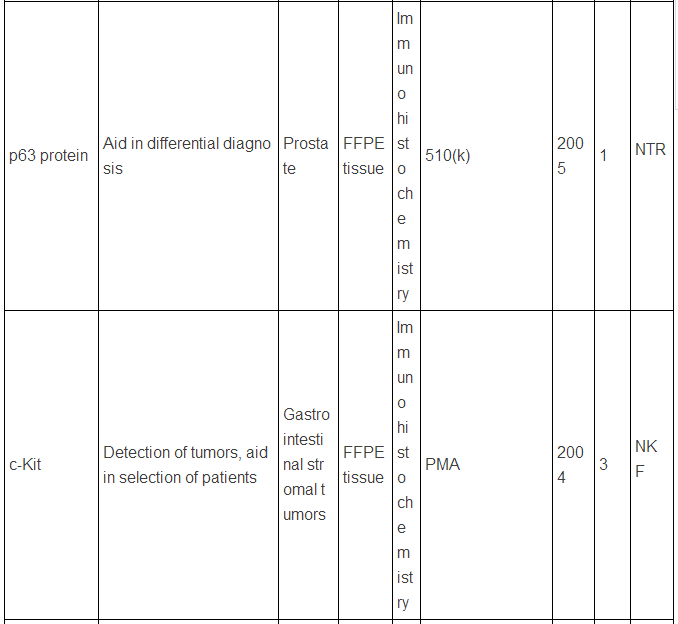
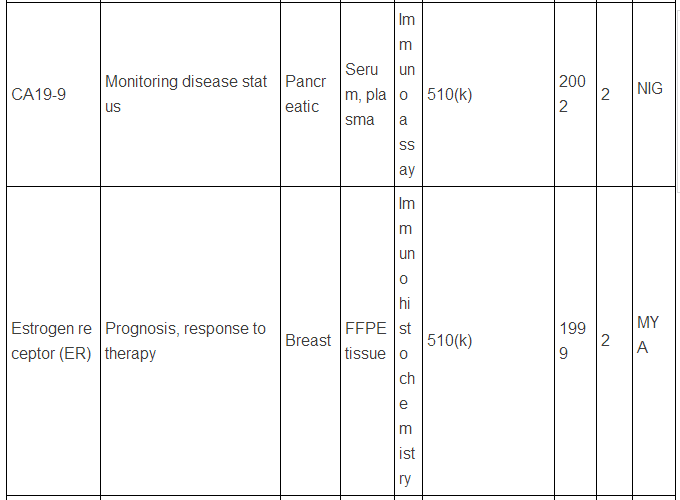
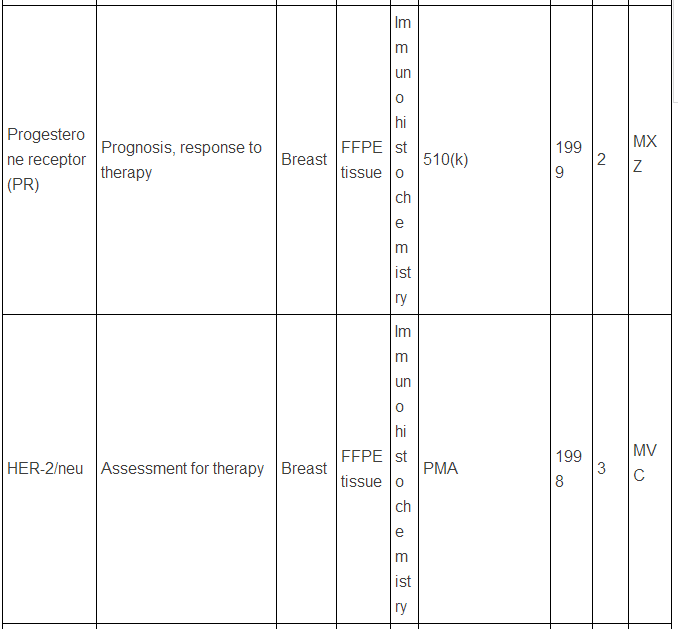
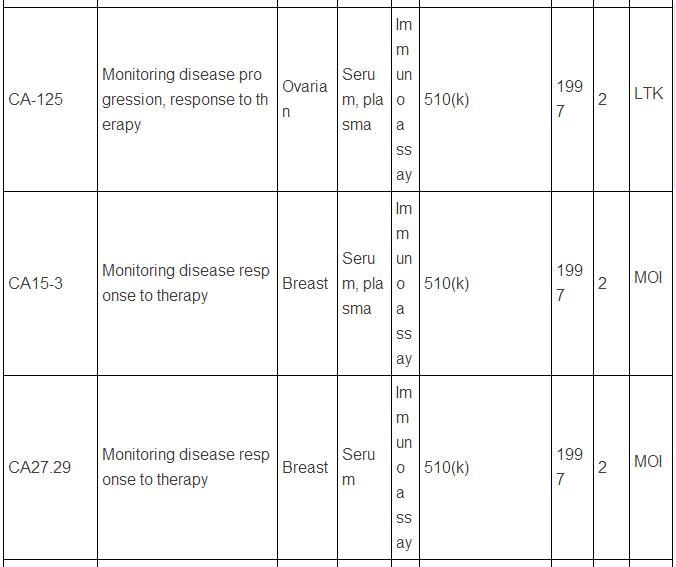
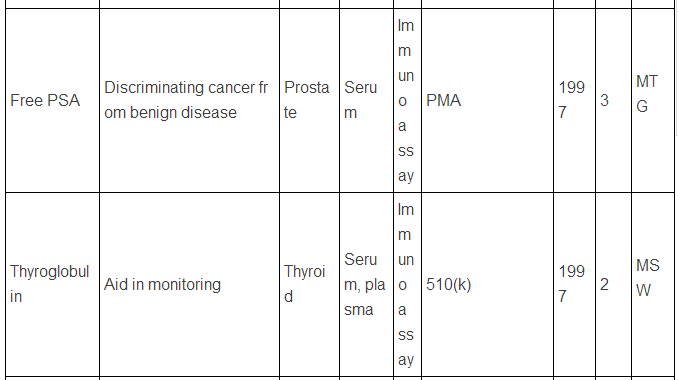
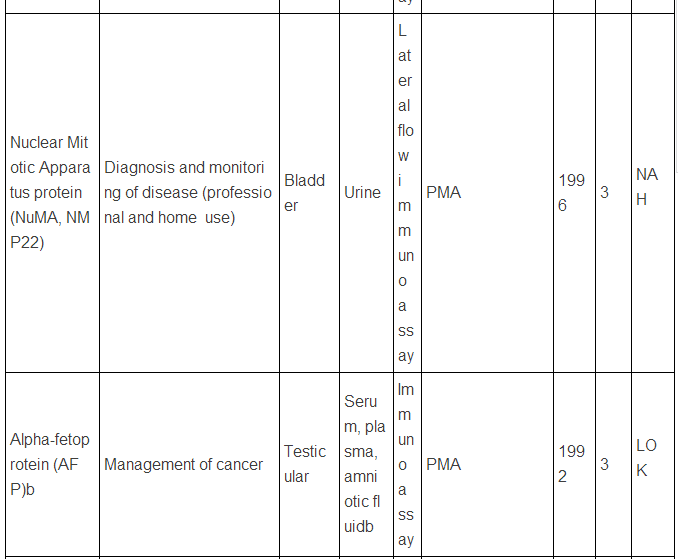
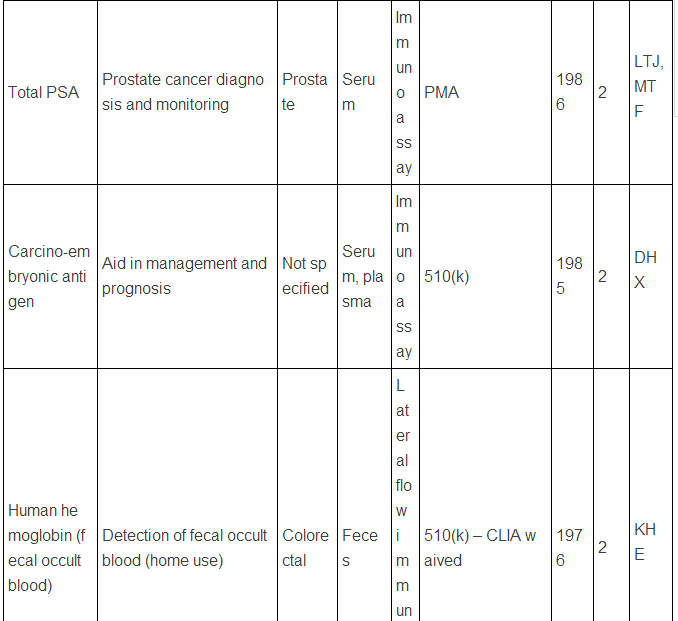

注:表中数据来自文献2.
上述中新网的报道还提到,罗教授的Hsp90α检测试剂盒“获得了国家第三类(最高类别)医疗器械证书”。生物标志物的临床检测使用是按照医疗器械来审批的,中国和欧美类似,医疗器械的审批都分为三类,第三类确实是最高类别,但是这个不是根据技术先进程度或者难度来衡量,而主要是根据医疗器械的用途和当医疗器械提供不正确结果(即假阳性、假阴性)时对病人所带来的风险。美国的医疗器械的临床使用申请主要分为两类:PMA(premarket approval application) 和510(k),由于自己对这两种申请途径不熟悉,不敢妄言,感兴趣的网友可以参见文末英文文献,该文献有较详细的介绍。
3、从转发数来看,好像围观群众们十分激动。那么,专业医生们都怎么看待这个新闻的呢?
这两天,网上各大官方媒体都在报道一项「重大突破」,称「一滴血可测癌症」!
从转发数来看,好像围观群众们十分激动。那么,专业医生们都怎么看待这个新闻的呢?
专家、医生看法
看看当事人 @ 罗永章 教授的看法:
「一滴血检测肿瘤」的说法很不准确,确切地讲,应该叫「监测肿瘤」。
再看看丁香园站友们怎么说:
@ 成都王淑玉:
即便是某项肿瘤标志物升高,也不能仅凭这一项就诊断为患了某种癌。有时某个部位有炎症,肿瘤标志物也有可能升高。诊断癌症还需要结合其他临床资料综合诊断。
@ 村医无颜小叔:
CEA 癌胚抗原结果数字高出一倍,也不能说这个人一定有癌症。这种定量分析还要借助临床综合分析的,可怕的宣传……
没错,罗永章教授的这项研究,其实是通过采血检测治疗前后 Hsp90α 的含量,从而对肺癌患者的病情进行监测和疗效评价。
Hsp90α 是一种肺癌相关的肿瘤标志物(tumor marker,TM),其实,除了它之外,还有很多肿瘤标志物,各个意义都不同。今天,丁香园(微信号:dingxiangwang)对它们进行了总结,快来看看吧。
TM 的正确临床意义
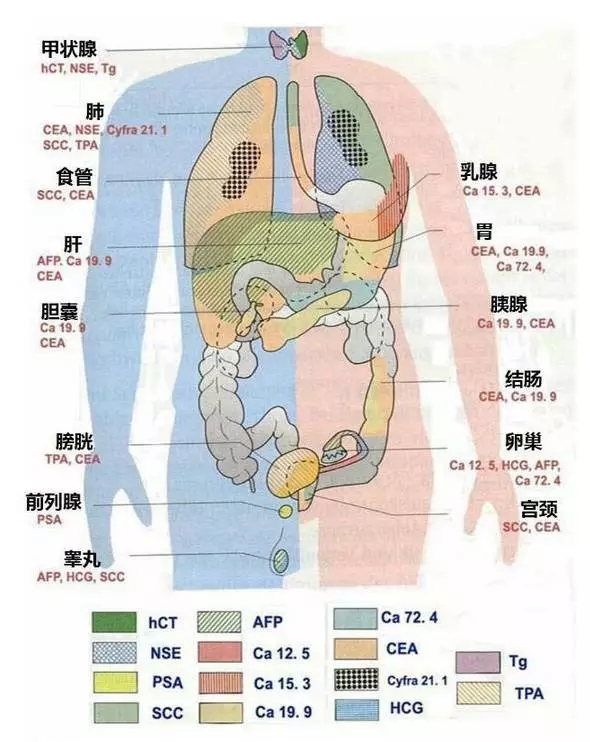
先上一张教科书的老图,还是能说明问题的。
那么,理想的 TM 应该是什么样的呢?
应该具有以下 6 点:
灵敏度高:以便于早期发现、早期诊断;
特异性高:仅肿瘤患者阳性、其他病都阴性,可鉴别肿瘤良恶性;
可定位:器官特异性,通过 TM 就知道这是一个肺癌还是乳腺癌;
评估病情:通过 TM 阳性率和浓度就知道肿瘤的进展情况、大小、严重度;
监控治疗效果:肿瘤治疗的疗效和复发情况;
预测预后:出现这个 TM 就知道预后好不好。
常见、通用的一些肿瘤血清 TM
CEA(癌胚抗原) 空腔脏器来源,肺腺癌特异性强。正常 ≤ 3 ng/mL(不吸烟) ≤ 10 ng/ml(吸烟),>20 ng/mL 提示消化肿瘤。是多种肿瘤转移、复发的标志。
SCC(鳞状细胞癌相关抗原)如其名,鳞癌特异性;宫颈癌的 TM。
CA125(糖类抗原 125)卵巢 TM,肺癌预后的独立 TM;正常<35 u/mL。
CA153 乳腺癌首选 TM,随肿瘤分期升高而升高;正常<28 ng/mL。
CA199 消化来源,胰腺癌最敏感(70%),其次是结直肠癌(45%)、肝癌(30%)。正常<37 U/mL。
CA242 消化来源。
NSE(神经元特异性烯醇化酶)小细胞肺癌 TM、神经胶质瘤 TM;神经内分泌来源,是脑转移的信号。
TPA(组织多肽抗原)反映活动、分化、浸润性。
肺癌血清 TM
CYFRA21-1(细胞角蛋白 21-1 片段)肺鳞癌首选 TM,敏感度 76.5%,非小细胞肺癌特异性 87%。
胃泌素释放肽前体(ProGRP)小细胞肺癌的 TM,灵敏度和特异性良好。在早期可发现,可用于高危小细胞肺癌患者的筛查,在日本已纳入常规体检项目。
p53 抑癌基因 p53 的产物,阳性率与肺鳞癌术后生存相关。
具体应用
肺腺癌:CEA(87%)、CA153
肺鳞癌:SCC、CYFRA21-1
小细胞肺癌:pro-GRP、NSE
非小细胞肺癌三联:CYFRA21-1 + CEA + p53
肺转移:CA199、CA153
复发:CEA
胃癌血清 TM
CA72-4 胃癌进展和疗效 TM,独立预后因子。
没有一种能满足早期诊断的敏感度和特异性,通常联合诊断。癌前病变和初期:CA199、CA242、CA724、CEA 升高。
肝癌血清 TM
AFP(甲胎蛋白)原发性肝癌和生殖系肿瘤 TM。正常 ≤ 20 ng/mL,无肝病活动、排除妊娠和生殖腺胚胎癌,≥ 400 ng/mL 持续 1 月或 ≥ 200 ng/mL 持续 2 月者,结合影像检查可诊断肝癌。
GP37(高尔基体蛋白 73)预测早期肝癌最有前景。
CK19 AFP 阴性肝癌早期诊断 敏感度 50%、特异度 90.9%。
CEA + AFP + CA125 敏感度可达 95.83%。
结直肠癌血清 TM
CEA、CA242、CA199 三者较敏感,然而联合检测不优于单一 CEA。
ESM-1(内皮细胞特异分子-1)正常<37.0 ng/mL,敏感度 90.91%、特异度 95%,随 TNM 分期升高而上升。它是未来之星。
胆管癌血清 TM
CA199 诊断价值最高,可联合 CA242、CEA、CA125 辅助诊断。
胰腺癌血清 TM
CEA + CA 199 + TSGF 三联。
乳腺癌血清 TM
CA153 早期敏感性较低(60%)、晚期敏感性为 80%,转移性阳性率较高(80%)、晚期骨转移阳性率可达 50%。
CA125 伴淋巴结转移、浸润阳性率达 44.6%。
前列腺癌血清 TM
PSA(前列腺癌特异性抗原) 包括总 PSA(t-PSA) 和游离 PSA(f-PSA)。正常 t-PSA<10 μg/L、fPSA<2.5 μg/L。f-PSA 较 t-PSA 敏感,当 t-PSA 正常而 f-PSA 升高时,可能提示前列腺癌。
卵巢癌血清 TM
HE4(人附睾蛋白 4)单项特异性、敏感性、准确度较高,CA125 对浆液性卵巢癌的敏感度高于粘液性。
CA125、CA153、AFP、HE4(人附睾蛋白 4)较敏感。
膀胱癌尿液 TM
NMP22(系核基质蛋白)鉴别良恶性膀胱疾病。
生殖肿瘤血清 TM
HCG(人绒毛促性腺激素)非妊娠情况下正常<8 U/L,肿瘤患者,一般检测β亚单位——β-HCG。
是男性睾丸肿瘤和女性恶性滋养细胞肿瘤(葡萄胎、侵袭性葡萄胎、绒毛膜癌)最基本的标记物。
 扫描下载
扫描下载体外诊断头条APP
 扫描关注
扫描关注CAIVD官方微信
 扫描关注
扫描关注CAIVD官方视频号
 扫描关注
扫描关注CACLP官方微信
 扫描关注
扫描关注CACLP官方视频号
全国卫生产业企业管理协会实验医学分会
( 京ICP备15010734号-10 )



