关于举办第六届中国药品监管科学大会的通知
更新时间:2022/10/13 14:16:31 浏览次数:45296各有关单位:
第六届中国药品监管科学大会将于2022年10月28日-30日在北京召开。
本次大会按照国家药品监督管理局领导的指示要求,深入贯彻习近平新时代中国特色社会主义思想,紧密围绕《“十四五”国家药品安全及促进高质量发展规划》,深入分析复杂的国际发展环境以及新冠疫情下的新趋势,准确把握药品监管新任务,探寻监管科学研究的新突破,助推药品监管体系和监管能力现代化,促进医药产业高质量发展。
大会诚邀研究会会员代表,各省(区、市)药品监督管理部门、科研院校、医疗机构、医药企业、相关行业协会等领导及有关人员参加此次盛会。现将有关事项通知如下:
一、大会主题
新趋势、新任务、新突破——监管科学助力监管能力建设和行业高质量发展
二、会议组织
指导单位:国家药品监督管理局
主办单位:中国药品监督管理研究会
合作单位:国家药品监督管理局药品审评中心、国家药品监督管理局信息中心、国家药品监督管理局高级研修学院、中国健康传媒集团、中国食品药品国际交流中心
支持单位:阿斯利康投资(中国)有限公司、赛诺菲(中国)投资有限公司、淄博千汇生物科技有限公司
三、大会报告
时间:2022年10月29日 地点:北京会议中心会议楼报告厅
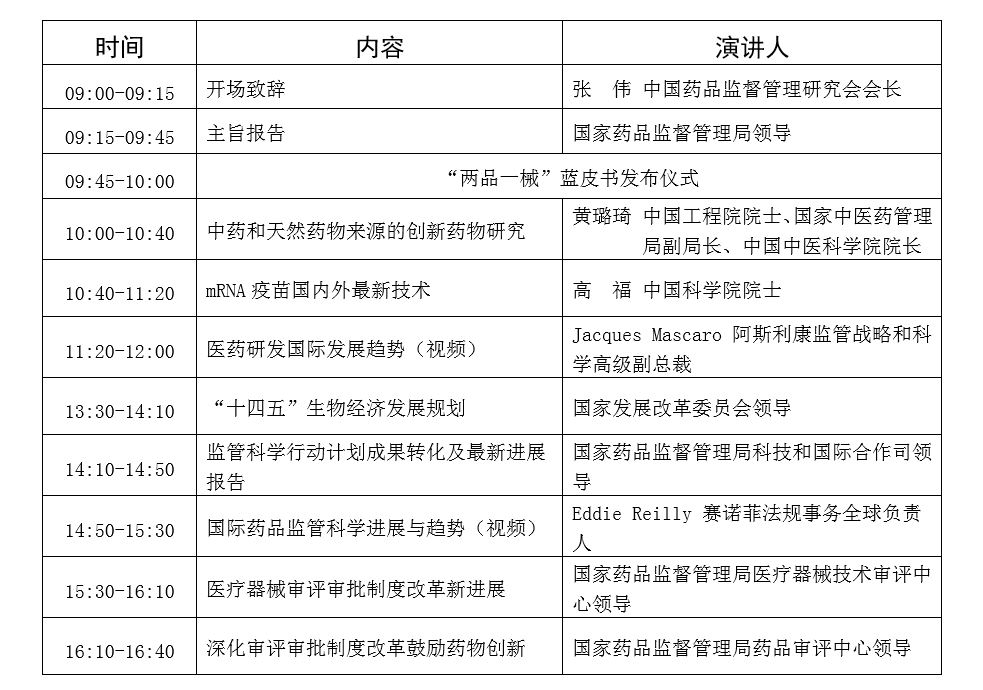
四、分论坛报告
论坛一:ICH指导原则解读论坛
时间:2022年10月30日 地点:北京会议中心东会议厅
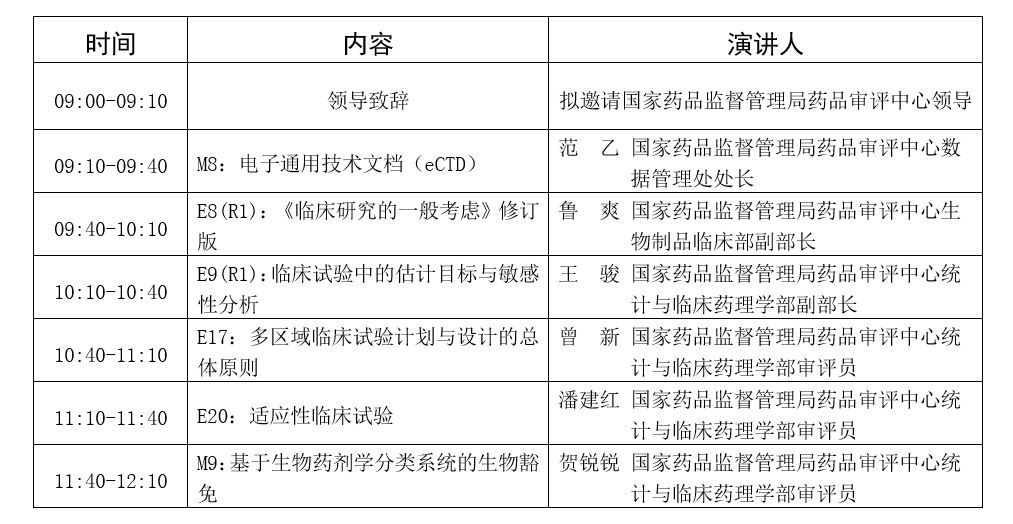
论坛二:药用辅料与包材监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼三层第19会议室
|
时间 |
内容 |
演讲人 |
|
08:30-09:00 |
《药品管理法实施条例》之原辅包政策解读 |
待 定 国家药品监督管理局药品注册司领导 |
|
09:00-09:30 |
《中国药典》2025版规划和辅料药包材标准制定展望 |
待 定 国家药典委员会领导 |
|
09:30-10:00 |
生物制品及药用辅料药包材变更技术要求 |
待 定 国家药品监督管理局药品审评中心专家 |
|
10:00-10:30 |
《药品管理法实施条例》新政下药用辅料药包材变更的途径与实践 |
待 定 国家药品监督管理局药品审评中心专家 |
|
10:30-11:00 |
儿童制剂及药用辅料的监管思路和技术要求 |
涂家生 中国药科大学教授、国家药典委员会药用辅料与药包材专业委员会主任委员 |
|
11:00-11:30 |
吸入制剂关键辅料和包材的开发及发展方向 |
王 健 药物制剂国家工程研究中心主任、上海呼吸系统药物工程技术研究中心主任 |
|
11:30-12:00 |
环糊精类药用辅料发展与展望 |
王丽萍 淄博千汇生物科技有限公司董事长 |
|
13:30-14:00 |
生物制品及其药用辅料非临床安全性评价技术要求 |
待 定 国家药品监督管理局药品审评中心专家 |
|
14:00-14:30 |
《药品管理法实施条例》新政下药包材变更的技术考量 |
孙会敏 中国食品药品检定研究院研究员、国家药品监督管理局药用辅料质量研究与评价重点实验室首任主任 |
|
14:30-15:00 |
API-辅料相互作用对难溶药物制剂行为的影响 |
钱 锋 清华大学药学院教授、副院长 |
|
15:00-15:30 |
药用辅料生物学活性的智能化研究 |
高建青 浙江大学(杭州)创新医药研究院副院长、浙江大学药物制剂研究所所长 |
|
15:30-16:00 |
大分子药用辅料精准分析及体内命运的研究 |
顾景凯 吉林大学药物代谢研究中心/吉林大学超分子结构与材料国家重点实验室教授 |
|
16:00-16:30 |
药品连续制造与原辅料实时放行 |
臧恒昌 山东大学药品监督科学研究院副院长、教授 |
|
16:30-17:00 |
药品注册检验管理要求与思考 |
黄宝斌 中国食品药品检定研究院综合业务处副处长、研究员 |
论坛三:医疗器械监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼三层第20会议室
|
时间 |
内容 |
演讲人 |
|
09:00-09:10 |
开场致辞 |
国家药品监督管理局领导 |
|
09:10-09:40 |
我国医疗器械注册制度改革新进展 |
国家药品监督管理局医疗器械注册司领导 |
|
09:40-10:10 |
我国医疗器械监管实践与创新 |
国家药品监督管理局医疗器械监管司领导 |
|
10:10-10:40 |
我国创新医疗器械审评实践 |
国家药品监督管理局医疗器械技术审评中心领导 |
|
10:40-11:10 |
我国医疗器械不良事件检测与评价 |
国家药品监督管理局药品评价中心领导 |
|
11:10-11:40 |
我国医疗器械发展现状与展望 |
王宝亭 中国药品监督管理研究会副会长 |
论坛四:细胞与基因治疗产品开发与监管论坛
时间:2022年10月30日 地点:北京会议中心八号楼多功能厅
|
时间 |
内容 |
演讲人 |
|
09:00-09:30 |
开场致辞 |
中国药品监督管理研究会领导 王 越 细胞与基因治疗产品监管研究专业委员会主任委员 |
|
09:30-10:00 |
细胞与基因治疗领域前沿技术的展望 |
赵阳兵 博士、上海优替济生生物医药有限公司董事长兼首席科学家 |
|
10:00-10:30 |
CGT产品药学开发的考虑 |
范 勇 博士、科济药业全球注册事务高级副总裁 |
|
10:30-10:45 |
茶 歇 |
|
|
10:45-11:15 |
CGT产品CMC变更管理 |
李月霞 博士、前美国FDA合规官 |
|
11:15-11:45 |
FDA对细胞与基因治疗产品的监管趋势 |
Dylan Bechtle 杨森全球监管政策副总监 |
|
13:30-14:00 |
细胞与基因治疗产品沟通交流中的临床共性问题 |
国家药品监督管理局药品审评中心临床审评专家 |
|
14:00-14:30 |
细胞与基因治疗产品沟通交流中的非临床共性问题 |
国家药品监督管理局药品审评中心非临床审评专家 |
|
14:30-15:00 |
细胞与基因治疗产品沟通交流中的药学共性问题 |
国家药品监督管理局药品审评中心药学审评专家 |
|
15:00-15:30 |
CGT产品在中国的IIT研究现状/现有CAR-T产品临床应用经验 |
王 迎 中国医学科学院血液病医院教授 |
|
15:30-16:00 |
休 息 |
|
|
16:00-18:00 |
细胞与基因治疗产品专委会(CGT专委会)2022年课题中期汇报会(闭门会) |
|
论坛五:政策法规论坛
时间:2022年10月30日 地点:北京会议中心六号楼第1会议室
|
时间 |
内容 |
演讲人 |
|
09:00-09:10 |
开场致辞 |
待 定 |
|
09:10-09:40 |
药品监管热点问题 |
拟邀请国家药品监督管理局政策法规司领导 |
|
09:40-10:10 |
药品网络销售监督管理制度 |
拟邀请国家药品监督管理局药品监管司领导 |
|
10:10-10:20 |
茶 歇 |
|
|
10:20-10:50 |
药品上市许可持有人制度实施热点问题 |
邵 蓉 中国药科大学教授 |
|
10:50-12:00 |
互动研讨 |
宋瑞霖 中国医药创新促进会执行会长 邵 蓉 中国药科大学教授 杨 悦 清华大学教授 其他专家待定 |
|
13:30-14:00 |
药品数据保护和市场独占期制度 |
杨 悦 清华大学教授 |
|
14:00-14:30 |
中药监管问题 |
田 侃 南京中医药大学教授 |
|
14:30-15:00 |
药品分类管理政策 |
待 定 |
|
15:00-15:30 |
大湾区药品跨境委托生产政策 |
拟邀请广东省药品监督管理局领导 |
论坛六:药品创新与国际化论坛
时间:2022年10月30日 地点:北京会议中心六号楼第2会议室
|
时间 |
内容 |
演讲人 |
|
|
13:30-13:35 |
领导致辞 |
中国药品监督管理研究会领导 |
|
|
13:35-13:40 |
嘉宾致辞 |
夏文璐 徕博科中国区总经理 |
|
|
13:40-14:05 |
中国创新药的监管思路和监管趋势 |
国家药品监督管理局药品注册司领导 |
|
|
14:05-14:30 |
创新生物标志物在生物医药临床研发不同阶段应用的经验分享 |
喻雄文 博士、徕博科Labcorp中心实验室全球检测服务亚太及日本总监 |
|
|
14:30-14:50 |
跨国药企的交叉融合与创新 |
李 晔 默克中国副总裁 |
|
|
14:50-15:10 |
合成致死领域药物在国内外发展及前景 |
谢志逸 博士、英派药业首席医学官 |
|
|
15:10-15:25 |
茶 歇 |
||
|
15:25-15:45 |
围绕ICH谈药物研发技术要求国际化的思考 |
国家药品监督管理局药品审评中心领导 |
|
|
15:45-16:05 |
药品监管的国际化思考(ICH) |
李自力 医学博士、DIA全球Fellow、强生集团杨森制药全球药物研发副总裁,亚太研发中心负责人 |
|
|
16:05-16:25 |
多元化创新战略 成就健康未来 |
Raphaël DeGarnier DesGarets 赛诺菲中国国际事务负责人 |
|
|
16:25-16:45 |
新冠期间全球药品监管灵活性措施积极对常态药品监管的启示 |
于 巍 赛诺菲(中国)投资有限公司监管科学与政策中国&亚洲负责人 |
|
|
16:45-17:05 |
“港澳药械通政策”及实施情况介绍 |
邱 楠 广东省药品监督管理局行政许可处处长 |
|
|
17:05-18:05 |
圆桌讨论:药品监管与创新的国际化 |
闫小军 |
百济神州全球药政事务负责人 |
|
姚 晨 |
北京大学临床研究所副所长、教授 |
||
|
待 定 |
国家药品监督管理局相关司局领导 |
||
|
待 定 |
国家药品监督管理局相关司局领导 |
||
|
毕吕存 |
博士、徕博科Labcorp生物分析实验室负责人 |
||
|
18:05-18:10 |
会议总结 |
||
论坛七:生物制品监管论坛
时间:2022年10月30日 地点:北京会议中心八号楼一层南贵宾厅
|
时间 |
内容 |
演讲人 |
|
08:00-08:30 |
领导致辞 |
中国药品监督管理研究会领导 |
|
08:30-09:30 |
mRNA疫苗设计的质量技术 |
林金钟 复旦大学教授 |
|
09:30-10:30 |
疫苗评价用动物模型建立 |
范昌发 中国食品药品检定研究院研究员 |
|
10:30-11:30 |
递送系统的质量控制及技术要求 |
胡一桥 南京大学教授 |
|
13:00-14:00 |
待 定 |
李玉华 中国食品药品检定研究院研究员 |
|
14:00-15:00 |
待 定 |
英 博 艾博生物博士 |
|
15:00-15:40 |
生物制品注册分类研究(暂定) |
杨 悦 清华大学药学院药品监管科学研究院院长 |
|
15:40-16:20 |
追寻科学奇迹——赛诺菲疫苗的创新历程 |
杜笑寒 博士、赛诺菲巴斯德对外研发亚太负责人 |
|
16:20-17:00 |
mRNA疫苗技术和质量控制 |
张 凡 艾美疫苗股份有限公司首席研究官 |
论坛八:化妆品监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼二层第11会议室
|
时间 |
内容 |
演讲人 |
|
09:00-09:10 |
开场致辞 |
国家药品监督管理局相关司局领导 中国药品监督管理研究会领导 |
|
研讨主题一 新法规、新政策 |
||
|
09:10-09:20 |
化妆品法规体系建设进展 |
国家药品监督管理局化妆品监管司领导 |
|
09:20-09:30 |
化妆品标准体系建设进展 |
中国食品药品检定研究院化妆品审评中心领导 |
|
09:30-09:40 |
化妆品监管科学研究报告 |
中国药品监督管理研究会化妆品监管研究专业委员会领导 |
|
09:40-09:50 |
化妆品行业政策研究报告 |
中国药品监督管理研究会化妆品监管研究专业委员会领导 |
|
09:50-10:20 |
化妆品政策法规焦点对话 |
国家药品监督管理局化妆品司、中检院、专委会、高等院校、企业界等专家学者 |
|
10:20-10:40 |
茶 歇 |
|
|
研讨主题二 新监管、新发展 |
||
|
10:40-10:50 |
化妆品注册备案最新态势 |
国家药品监督管理局化妆品监管司领导 |
|
10:50-11:00 |
化妆品市场监管最新态势 |
国家药品监督管理局化妆品监管司领导 |
|
11:00-11:10 |
化妆品飞行检查最新态势 |
国家药品监督管理局审核查验中心领导 |
|
11:10-11:20 |
化妆品质量抽检最新态势 |
中国食品药品检定研究院检验机构领导 |
|
11:20-12:00 |
化妆品行业发展焦点对话 |
国家药品监督管理局化妆品监管司、中国食品药品检定研究院、化妆品监管研究专业委员会、高等院校、企业界等专家学者 |
论坛九:中药监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼二层第13会议室
|
时间 |
内容 |
演讲人 |
|
08:30-08:40 |
嘉宾介绍、开场致辞 |
主持人 |
|
08:40-09:20 |
打造中药监管科学研究高地,推进我国药品监管科学化 |
徐安龙 北京中医药大学校长、国家药品监督管理局中药监管科学研究院院长、国家药品监督管理局中医药研究与评价重点实验室主任 |
|
09:20-09:50 |
待 定 |
拟邀请国家药品监督管理局药品注册管理司有关领导 |
|
09:50-10:20 |
待 定 |
拟邀请国家药品监督管理局药品审评中心有关领导 |
|
10:20-10:30 |
茶 歇 |
|
|
10:30-11:00 |
药物创新监管制度的思考和建议 |
唐健元 成都中医药大学附属医院副院长 |
|
11:00-11:30 |
中药潜在毒性范例研究 |
王 停 北京中医药大学中药学院书记、北京中医药研究院常务副院长 |
|
11:30-12:00 |
会议讨论与总结 |
|
论坛十:国际仿制药论坛
时间:2022年10月30日 地点:北京会议中心会议楼二层第15会议室
|
时间 |
内容 |
演讲人 |
|
09:00-09:05 |
嘉宾介绍、开场致辞 |
主持人 |
|
09:05-09:15 |
开幕致辞 |
张 伟 中国药品监督管理研究会会长 |
|
09:15-09:35 |
无参比制剂监管相关法规解读(待定) |
拟邀请国家药品监督管理局药品注册管理司 |
|
09:35-09:55 |
中国仿制药一致性评价工作最新进展 及常见问题解析 |
拟邀请仿制药一致性评价办公室 |
|
09:55-10:15 |
特殊注射剂的仿制药一致性评价 |
拟邀请国家药品审评中心药学二部 |
|
10:15-10:35 |
连续制造国内外监管情况介绍及落地 实施思考 |
曹 萌 上海药品审评核查中心副部长 |
|
10:35-10:55 |
云端递交 云端递交加速药品研发, 促进审评审批现代化 |
赵岩松 罗氏(中国)投资有限公司法规政策总监 |
|
10:55-11:15 |
电子说明书国际法规动态及实施进展 |
田云怡 百时美施贵宝中国投资有限公司 注册事务部高级经理 |
|
11:15-11:45 |
讨论环节 |
|
|
11:45-11:55 |
会议总结 |
|
|
13:30-13:40 |
嘉宾介绍、开场致辞 |
主持人 |
|
13:40-14:00 |
仿制药监管的国际发展趋势 |
陈少羽 美国安诺波特律师事务所驻上海代表处管理合伙人 |
|
14:00-14:20 |
中国医药产业国际化发展的几点思考 |
王茂春 中国医药保健品进出口商会副会长 |
|
14:20-14:40 |
中国医药行业发展蓝皮书(2015-2020)解读 |
郭 文 中国医药工业信息中心主任 |
|
14:40-15:00 |
真实世界数据在上市后药品再评价中的应用 |
封宇飞 北京大学人民医院临床研究机构主任 |
|
15:00-15:20 |
待 定 |
待 定 印度瑞迪制药 |
|
15:20-15:50 |
讨论环节 |
|
|
15:50-16:00 |
会议总结 |
|
论坛十一:药物警戒研究与管理论坛
时间:2022年10月30日 地点:北京会议中心会议楼二层第16会议室
|
时间 |
内容 |
演讲人 |
|
09:00-09:10 |
领导致辞 介绍参会嘉宾 |
李国庆 国家药品监督管理局政策法规司原一级巡视员 |
|
09:10-09:35 |
《药物警戒质量管理规范》与《药物警戒检查指导原则》解读 |
国家药监局药品监督管理司药物警戒处 |
|
09:35-10:00 |
基于新药上市后药物警戒工作开展的实践 |
国家药监局药品审评中心 |
|
10:00-10:25 |
中国ADR监测哨点医院建设及发展 |
国家药监局药品评价中心 |
|
10:25-10:50 |
药品生产企业风险控制及药品的临床合理使用 |
李国庆 国家药品监督管理局政策法规司原一级巡视员 |
|
10:50-11:15 |
医疗机构医务人员药物警戒及相关知识认知的调查与分析 |
赵志刚 首都医科大学附属北京天坛医院 |
|
11:15-11:40 |
跨国企业药物警戒战略与实践 |
岳晨妍 赛诺菲 |
|
11:40-12:00 |
嘉宾讨论、会议总结 |
|
论坛十二:药品流通监管与药品监管信息化论坛
时间:2022年10月30日 地点:北京会议中心会议楼一层第3会议室
|
时间 |
内容 |
演讲人 |
|
08:30-08:40 |
开场致辞 |
中国药品监督管理研究会领导 |
|
08:40-09:20 |
药品网络销售监管政策解读 |
国家药品监督管理局药品监管司领导 |
|
09:20-10:00 |
“十四五”背景下促进药品流通行业高质量发展政策暨2021年药品流通行业运行统计分析报告解读(拟) |
待 定 |
|
10:00-10:30 |
“十四五”药品监管网络安全与信息化规划及涉企电子证照推进进展 |
国家药品监督管理局信息中心领导 |
|
10:30-11:00 |
“十四五”国民健康规划背景下药品供应保障体系完善(拟) |
待 定 |
|
11:00-11:30 |
数智结合 推进医保信息化标准化建设(拟) |
待 定 |
|
11:30-11:50 |
《互联网药品零售末端配送质量与服务管理规范》暨行业自律行动宣言(拟) |
待 定 |
|
11:50-12:00 |
会议总结 |
中国药品监督管理研究会药品监管信息化研究专业委员会领导 |
论坛十三:药品使用监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼一层第5会议室
|
时间 |
内容 |
演讲人 |
|
08:30-08:40 |
开场致辞 |
中国药品监督管理研究会领导、药品使用监管研究专业委员会主任委员 |
|
08:40-09:10 |
药品管理法实施条例解读 |
国家药品监督管理局政策法规司领导 |
|
09:10-09:40 |
药师在医保基金管理中的地位和作用 |
熊先军 国家医保局医药服务管理司原司长 |
|
09:40-10:20 |
附条件上市药品的风险管理 |
国家药品监督管理局药品审评中心有关领导 |
|
10:20-10:30 |
茶 歇 |
|
|
10:30-11:00 |
待 定 |
|
|
11:00-11:30 |
PD-1/PD-L1使用风险管理 |
李国辉 中国医学科学院肿瘤医院药剂科主任 |
|
11:30-12:00 |
药品使用风险管理使用手册丛书发布仪式-主委致辞、丛书介绍、丛书发布授书仪式 |
|
论坛十四:监管科学论坛
时间:2022年10月30日 地点:北京会议中心八号楼会议厅
|
时间 |
内容 |
演讲人 |
|
09:00-10:00 |
中国药品监督管理研究会监管科学研究分会成立大会 |
国家药品监督管理局领导、中国药品监督管理研究会领导、监管科学研究分会会长 |
|
10:00-10:10 |
合 影 |
|
|
10:10-10:30 |
茶 歇 |
|
|
10:30-11:00 |
主题报告待定 |
国家药品监督管理局科技和国际合作司领导 |
|
11:00-11:30 |
发展监管科学 促进中药产业传承创新 |
刘昌孝 中国工程院院士 天津中医药大学中药学院院长 |
|
11:30-12:00 |
监管科学研究推动医工转化 |
王迎军 中国工程院院士 华南理工大学国家药监局医疗器械监管科学研究基地主任 |
|
13:30-14:00 |
监管科学研究分会第一次全体会议 |
监管科学研究分会全体委员 |
|
14:00-14:20 |
因果推断在药品医疗器械监管科学的应用 |
周晓华 北京大学国家药品医疗器械监管科学研究院副院长 |
|
14:20-14:40 |
职业化药品检查员队伍建设存在的问题与思考 |
王凤山 山东大学药品监管科学研究院执行院长 |
|
14:40-15:00 |
医疗器械监管科学跨越式发展 |
王明辉 四川大学医疗器械监管科学研究院院长 |
|
15:00-15:20 |
打造中药监管科学研究高地 推进我国药品监管科学化 |
雷海民 北京中医药大学中药学院院长 中药监管科学研究院执行院长 |
|
15:20-15:40 |
茶 歇 |
|
|
15:40-16:00 |
特色植物资源化妆品的研发 |
孟 宏 北京工商大学化妆品监管科学研究院执行院长 |
|
16:00-16:20 |
汇聚政产学研各方资源 打造真实世界研究高地 |
符 祝 海南省真实世界数据研究院副院长 |
|
16:20-16:40 |
真实世界研究的全球法规进展 |
Felipe Dolz 赛诺菲监管科学与政策 全球负责人 |
|
16:40-17:00 |
以药品为主的药械组合产品注册法规体系的思考和建议 |
李流兵 阿斯利康全球研发 (中国) 有限公司 药品注册副总监 |
|
17:00-18:00 |
“监管科学与行业高质量发展”高端论坛 |
主题/邀请报告人 |
论坛十五:新发突发传染病防控科学监管论坛
时间:2022年10月30日 地点:北京会议中心会议楼第1会议室
|
时间 |
内容 |
演讲人 |
|
08:30-08:40 |
开场致辞 |
中国药品监督管理研究会领导 |
|
08:40-09:10 |
新发突发传染病创新药物评价体系 |
国家药品监督管理局相关司局领导 |
|
09:10-09:40 |
生物制品药物监管模式 |
待 定 |
|
09:40-10:10 |
突发公共卫生事件应急状态下的公民权利保障与限制 |
待 定 |
|
10:10-10:20 |
茶 歇 |
|
|
10:20-10:50 |
中国新冠免疫预防现状及策略的改进 |
待 定 |
|
10:50-11:20 |
新冠诊疗方案解读 |
待 定 |
|
11:20-11:50 |
新冠预防和诊疗中未被满足的需求 |
待 定 |
|
11:50-12:00 |
会议小结 |
|
|
13:30-15:30 |
圆桌讨论: 1、 脆弱群体的防护对我国整体疫情防控的意义? 2、 创新生物制品药物在新发突发传染病防控体系中的价值定位? |
多学科专家 |
|
15:30-15:40 |
会议总结 |
|
五、时间与地点
时间:2022年10月28日-30日
地点:北京会议中心(北京市朝阳区来广营西路88号)
六、大会注册及费用
注册方式:
1、网站注册:https://meeting.lcmice.com/?conferenceId=167
2、APP注册:请扫描以下二维码注册

会议费用(含材料及午餐费,不含交通和住宿费):
1、各省、自治区、直辖市药品监督管理部门代表免2名注册费;
2、中国药品监督管理研究会个人会员免收注册费,单位会员免收2名注册费;
3、普通参会代表在2022年10月14日(含)前(以交费为准)注册,2000元/人,2022年10月14日之后和现场(以交费为准)注册,2300元/人。
参会人数控制在1200人之内,超出名额,不再受理注册。
七、联系方式
联系人:邵心宇、李奇洋
电 话:17816616195、010-82210562
邮 箱:xinyu_shao@126.com、Lj19870829@163.com
八、注意事项
1.大会及各分论坛讲演内容可能会做微调,以现场发布为准。
2.疫情防控要求将根据会期当时北京疫情防控形势另行通知。
各分论坛秘书处
论坛一:ICH指导原则解读论坛
联系人:张元媛
电 话:13910109685
论坛二:药用辅料与包材监管论坛
联系人:田瑞雪
电 话:18101858037
论坛三:医疗器械监管论坛
联系人:王 艳
电 话:15562681133
论坛四:细胞与基因治疗产品开发与监管论坛
联系人:李付英、周新腾
电 话:13311074885、13621119509
论坛五:政策法规论坛
联系人:蒋 蓉
电 话:13770643566
论坛六:药品创新与国际化论坛
联系人:陈润珊
电 话:13911322307
论坛七:生物制品监管论坛
联系人:张 莹
电 话:13888104041
论坛八:化妆品监管论坛
联系人:李 彬
电 话:17708255510
论坛九:中药监管论坛
联系人:杨 颂
电 话:18910350187
论坛十:国际仿制药论坛
联系人:马文利
电 话:13901185677
论坛十一:药物警戒研究与管理论坛论坛
联系人:张伊楠
电 话:15611732047
论坛十二:药品流通监管与药品监管信息化论坛
联系人:赵 烨
电 话:18500566793
论坛十三:药品使用监管论坛
联系人:耿莉莉
电 话:18101370949
论坛十四:监管科学论坛
联系人:薛永业
电 话:13925114336
论坛十五:新发突发传染病防控科学监管论坛
联系人:刘筱茜
电 话:13581972657



 扫描下载
扫描下载体外诊断头条APP
 扫描关注
扫描关注CAIVD官方微信
 扫描关注
扫描关注CAIVD官方视频号
 扫描关注
扫描关注CACLP官方微信
 扫描关注
扫描关注CACLP官方视频号
全国卫生产业企业管理协会实验医学分会
( 京ICP备15010734号-10 )



